
2020年10月7日,诺贝尔化学奖授予了Emmanuelle Charpentier和Jennifer A. Doudna,以表彰她们开发出一种基因组编辑的方法——CRISPR-Cas9。自从科学家们研究清楚CRISPR-Cas系统的作用机理并将其应用于真核细胞的基因编辑后,相关工具的开发、改造和应用呈爆发式增长,成为生物学研究的重要手段。目前主要的CRISPR编辑工具有Cas9、Base editor (BE) 和Prime editor (PE),及衍生的各种工具。CRISPR编辑工具在基因功能研究、转录调控、表观遗传修饰和基因治疗等众多研究领域具有重要应用和广阔前景。但是,CRISPR介导的编辑工具普遍具有gRNA依赖的脱靶效应,会导致意料之外的基因编辑所带来的不可预知的后果, 特别是临床应用中的潜在脱靶风险。因此,定义和改进这些编辑工具的全基因组或全转录组的特异性,对于充分发挥它们在基础研究和生物医学治疗中的全部潜力至关重要。此外,在工具的开发和改进中,特异性的精确评估,是工具的合理化选择和针对性优化的基础。总之,全面而精确地评估CRISPR编辑工具的脱靶效应是基因编辑领域的热点和难点。
2022年7月15日,中山大学生科院骆观正课题组、梁普平课题组,芝加哥大学何川课题组合作,在Protein & Cell杂志发表了题为 Systematic identification of CRISPR off-target effects by CROss-seq 的研究论文。该论文提出一种通用、高效、可扩展的脱靶检测方法,可以系统地评估快速增长的CRISPR DNA编辑器家族中多个成员的脱靶效应,将有助于更深入地理解CRISPR介导的工具,以实现更广泛的应用场景。

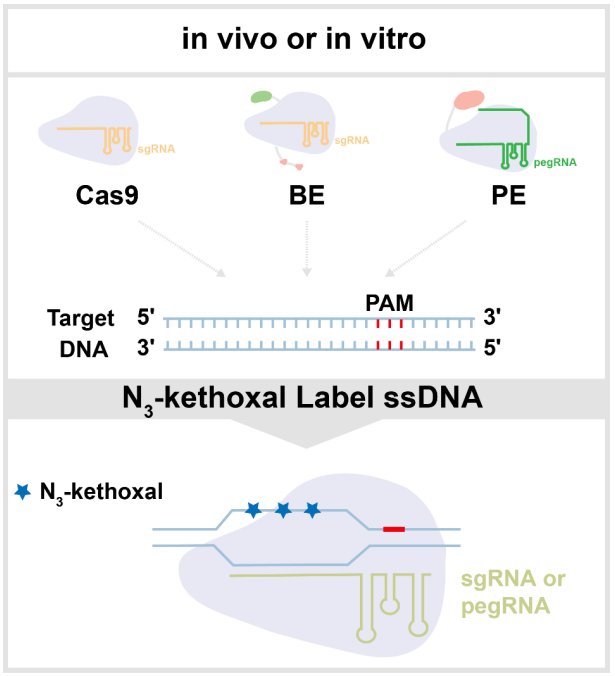
近几年,科学家们已经开发了多种基于下一代测序(NGS)的脱靶检测方法,以评估特定工具的特异性和准确性。例如,Digenome-seq、SITE-seq和CIRCLE-seq等方法通过直接检测核酸酶切割位点,在体外分析CRISPR-Cas9的全基因组脱靶效应。但是,因为体外切割活性与体内编辑活性的相关性很低,所以体外方法具有非常高的假阳性。基于细胞的方法(体内方法),例如BLESS/BLISS、HTGTS、IDLV、GUIDE-seq,可以在体内对脱靶位点进行有效检测。然而,它们容易受到内源性细胞活动的干扰,如DNA自发损伤、DNA修复、细胞分裂、供体序列整合等,影响脱靶检测的灵敏度。碱基编辑器和先导编辑器不诱导双链DNA断裂,从而在很大程度上避免了基因治疗中的意外编辑,但在临床应用之前,对其脱靶效应进行全面评估至关重要。研究人员已经建立了Digenome-seq衍生的方法来识别BE(ABE7.10和BE3)的脱靶效应,尽管它只能应用于体外系统,并且倾向于高估脱靶位点的数量。最近报道的基于dU检测和富集的Detect-seq可以在体内评估CBE的特异性。nDigenome-seq是第一种检测PE脱靶效应的方法,它依赖于体外Cas9 H840A切口酶诱导的SSB。重要的是,上述方法只适用于特定类型的工具,不能兼容细胞外和细胞内环境,而且每种方法都有各自的局限性,通用、高效、可扩展的脱靶检测方法仍匮乏。
鉴于以上背景,本研究提出开发一种通用、高效、可扩展的脱靶检测新方法。最近芝加哥大学何川教授课题组报道了检测转录活动中瞬时形成R-loop的技术KAS-seq。其中关键的N3-kethoxal分子可以在体外和原位高度特异地标记和捕获ssDNA。本研究利用了CRISPR工具的一个共同特征,即依赖于RNA引导的位点特异性DNA识别会形成R-loop结构并暴露出ssDNA。因此,通过检测靶向识别诱导产生的R-loop的ssDNA,就可以获知基于CRISPR基因编辑工具的靶向和脱靶位点。根据上述原理,本研究成功开发了CROss-seq,并在体外和体内全面而系统地评估了Cas9、BE(CBE和ABE)和PE的靶向特异性。本研究发现,体外和体内的脱靶检测方法具有明显的差异,其中染色质可及性对脱靶活性有显著影响,强调了结合体外和体内实验进行交叉验证的必要性。此外,CROss-seq可同时检测BE系统的体外、体内脱靶位点,并交叉验证体内脱靶位点的编辑,比单一体内或体外的方法具有更高的灵敏度和准确度。最后,CROss-seq可实现PE系统的体内脱靶位点检测和编辑验证,相关结果表明PE系统具有非常高的靶向特异性。综上所述,CROss-seq可以帮助更好地评估当前可用的,以及未来可能的CRISPR 基因组编辑工具的脱靶效应,为促进CRISPR编辑工具在基础研究和基因治疗中的广泛应用提供方法学创新。
中山大学生科院博士生李言、支胜尧,芝加哥大学吴桐博士为该论文共同第一作者,中山大学生科院骆观正教授、梁普平副教授和芝加哥大学何川教授为共同通讯作者。中山大学生科院博士生陈鸿萱、马冬曌和康睿参与了该项工作,松阳洲教授对论文进行了指导。
原文链接:
https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwac018/6645195
https://doi.org/10.1093/procel/pwac018
制版人:十一

转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




