
责编|酶美
巨胞饮(macropinocytosis)是细胞非选择性内吞胞外液体的过程。这一特殊的细胞内吞行为是由美国生物学家Warren Lewis最早发现并命名的,并将形成的大小不一的内吞囊泡命名为巨胞饮体(macropinosome)。后来的研究证明,巨胞饮在多种细胞类型中发生。例如,阿米巴细胞利用其获取环境中的营养物质,免疫细胞利用其捕获抗原,神经细胞利用其内吞膜受体调节突触信号【1-3】。巨胞饮也与许多疾病的发生相关,例如在神经退行性疾病中介导蛋白聚集体在细胞间的传递、被病原体利用入侵宿主细胞等【4, 5】。近年来的研究也发现,某些肿瘤细胞能够通过上调巨胞饮摄取蛋白质和脂肪酸等营养物质,从而在肿瘤微环境中维持生长优势【6】。
巨胞饮与其它内吞形式存在相似之处,形成的囊泡结构都经历向细胞中心移动、酸化、最终与溶酶体融合等步骤,但该过程也具有若干鲜明的特点。首先,巨胞饮提供了一种内化大量溶质和膜的途径。巨胞饮体的直径一般在0.2~5微米,远大于被广泛研究的网格蛋白形成的内吞泡的大小。据测算,巨噬细胞通过巨胞饮可以在30分钟内化其整个细胞表面,1-2小时内吸收相当于整个细胞体积的液体量【7】。其次,巨胞饮不依赖包被蛋白或固体颗粒模板,而是由肌动蛋白驱动质膜发生形变,进一步形成内吞囊泡【8】。这些巨胞饮过程特性的背后蕴藏复杂的调控机理,然而目前对巨胞饮体形成和成熟的分子机制仍知之甚少。
中科院生物物理研究所蔡华清教授团队在模式生物盘基网柄菌(Dictyostelium discoideum)中建立了巨胞饮研究体系。前期研究中,她们通过遗传和生化筛选,鉴定获得了一系列新的巨胞饮调控因子【9, 10】。
2022年4月4日,Nature Communications杂志在线发表了中科院蔡华清研究团队的研究成果:The PripA-TbcrA complex-centered Rab GAP cascade facilitates macropinosome maturation in Dictyostelium。该项研究揭示了巨胞饮体成熟过程中,由Rab5、Rab7、PripA和TbcrA构成的RabGAP信号级联通路调控巨胞饮体成熟和货物降解的作用。

内吞囊泡在成熟过程中往往涉及小GTP酶和肌醇磷脂的精确时空调控。为了解析巨胞饮体成熟过程的分子机制,研究者首先观察了Rab小GTP酶的动态变化,发现巨胞饮体在从质膜上分离后会依次被Rab5和Rab7标记。有趣的是,研究者发现,在从Rab5标记的早期巨胞饮体向Rab7标记的晚期巨胞饮体转变的过程中,Rab7并不像经典模型中描述的那样是从胞质中被招募到囊泡结构上的。相反,当Rab5标记的早期巨胞饮体进入细胞中约20-30秒后,大量Rab7标记的晚期巨胞饮体会定位在Rab5囊泡结构的周围并与之融合。这一现象表明巨胞饮体成熟过程中Rab5向Rab7的转化依赖晚期巨胞饮与早期巨胞饮体的融合。
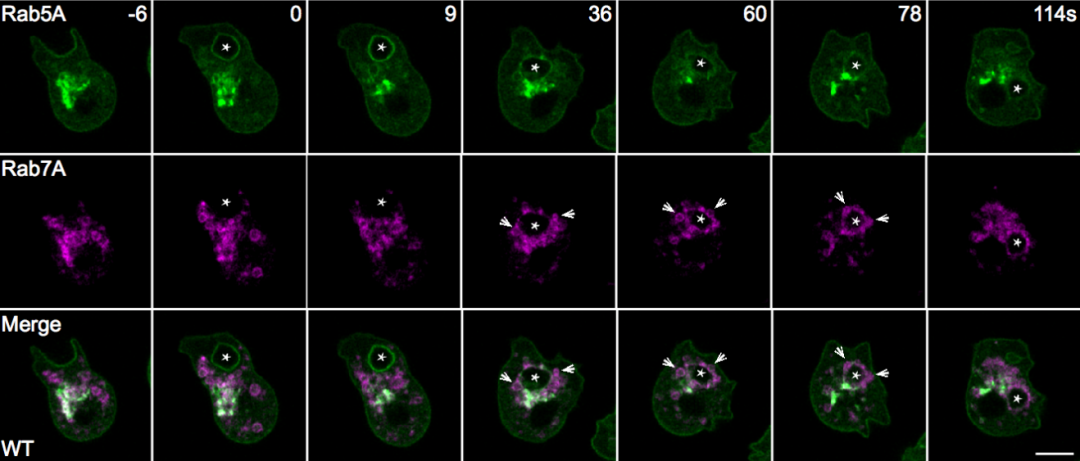
进一步研究者通过对在Rab5向Rab7的转化阶段特异定位于巨胞饮体上的蛋白的筛选,发现了由包含PH结构域的一个蛋白和包含RabGAP结构域的一个蛋白所组成的蛋白复合体,并将这两个蛋白分别命名为PripA和TbcrA。结合延时荧光成像、酵母双杂交和一系列生化实验,研究者证明PripA分别与早期巨胞饮体上的PI(3,4)P2和晚期巨胞饮体上的Rab7结合,从而为两种巨胞饮体膜结构之间建立链接。与此同时,PripA招募TbcrA,而后者作为Rab5的GAP促进Rab5-GTP的水解,从而保证在晚期巨胞饮体与早期巨胞饮体融合的过程中Rab5被及时失活。pripA或tbcrA基因的缺失会抑制Rab5的失活,并阻碍巨胞饮体的成熟和内吞货物的降解。TbcrA的GAP结构域中保守的催化残基的突变也会造成类似的巨胞饮内吞货物降解的缺陷以及Rab5的延迟失活。此外,研究者发现PripA-TbcrA复合体在细胞吞噬细菌和酵母等微生物的过程中也发挥类似的功能,从而促进吞噬体的成熟。
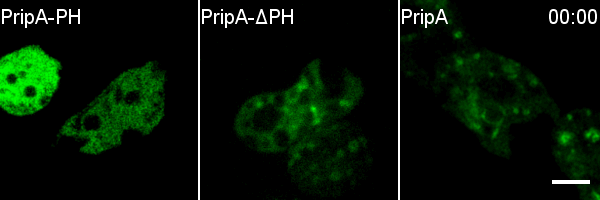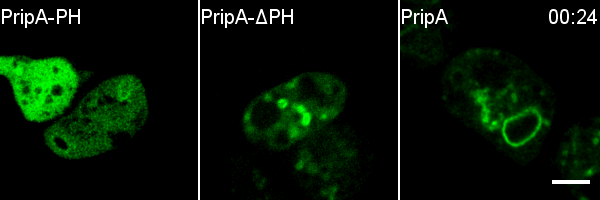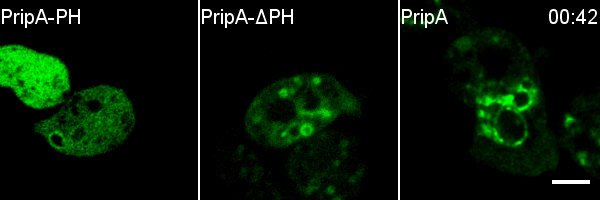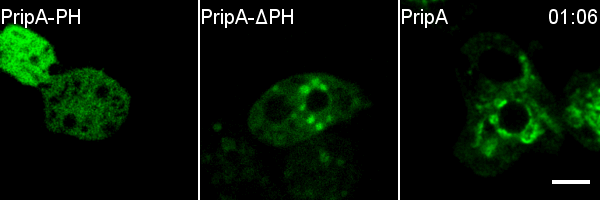
综上所述,该研究揭示了Rab5、Rab7和PripA-TbcrA复合物以Rab GAP级联(Rab GAP cascade)的形式调控巨胞饮体成熟的分子机制。在该调控机制中,处于信号通路下游的Rab7通过膜融合的方式被富集到巨胞饮体上,Rab7再通过招募GAP蛋白抑制通路上游的Rab5的活性,从而确保巨胞饮体成熟过程中Rab小GTP酶转化的方向性,使得细胞能高效地处理巨胞饮内吞的货物,进而及时获取维持细胞生长和增殖的营养物质。这项研究不仅解析了巨胞饮内吞囊泡成熟过程的调控机制,也提示我们不同来源的内吞囊泡加工方式的多样性,为深入探究细胞内吞过程的分子机制奠定了重要的基础。

中科院生物物理研究所涂慧博士为本论文的第一作者,蔡华清研究员为本论文的通讯作者。
蔡华清研究员课题组致力于探究细胞巨胞饮和细胞运动的分子机制及其与疾病的关系,近期发表PNAS (2020)、J Cell Biol (2021)、Front Cell Dev Biol (2022)、J Cell Sci (2022)等相关研究。课题组拟招收细胞生物学方向的博士后/助研,我们热忱欢迎在科学研究方面充满热情的青年学者加入我们的队伍。

原文链接:
https://doi.org/10.1038/s41467-022-29503-1
参考文献
1. Clayton, E.L. and M.A. Cousin, The molecular physiology of activity-dependent bulk endocytosis of synaptic vesicles. Journal of Neurochemistry, 2009. 111(4): p. 901-914.
2. Vargas, P., et al., Innate control of actin nucleation determines two distinct migration behaviours in dendritic cells. Nature Cell Biology, 2016. 18(1): p. 43-+.
3. Buckley, C.M. and J.S. King, Drinking problems: mechanisms of macropinosome formation and maturation. Febs Journal, 2017. 284(22): p. 3778-3790.
4. Saeed, M.F., et al., Cellular entry of ebola virus involves uptake by a macropinocytosis-like mechanism and subsequent trafficking through early and late endosomes. PLoS Pathog, 2010. 6(9): p. e1001110.
5. Zeineddine, R. and J.J. Yerbury, The role of macropinocytosis in the propagation of protein aggregation associated with neurodegenerative diseases. Frontiers in Physiology, 2015. 6.
6. Palm, W., Metabolic functions of macropinocytosis. Philosophical Transactions of the Royal Society B-Biological Sciences, 2019. 374(1765).
7. Freeman, S.A. and S. Grinstein, Resolution of macropinosomes, phagosomes and autolysosomes: Osmotically driven shrinkage enables tubulation and vesiculation. Traffic, 2018. 19(12): p. 965-974.
8. Veltman, D.M., et al., A plasma membrane template for macropinocytic cups. eLife, 2016. 5.
9. Yang, Y., et al., Leep1 interacts with PIP3 and the Scar/WAVE complex to regulate cell migration and macropinocytosis. J Cell Biol, 2021. 220(7).
10. Zhang, Y., et al., Oligopeptide transporter Slc15A modulates macropinocytosis in Dictyostelium by maintaining intracellular nutrient status. J Cell Sci, 2022.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




