您还不是认证园区!
赶快前去认证园区吧!

整理:小桔灯网
作者:归去来兮
依据原国家食品药品监督管理总局《医疗器械优先审批程序》,国家药品监督管理局医疗器械技术审评中心对申请优先审批的医疗器械注册申请进行了审核。
截至2021年6月,共有24个项目符合优先审批情形,拟定予以优先审批,予以公示。

(点击可查看大图)
依据国家药品监督管理局《创新医疗器械特别审查程序》要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查。
截至2021年6月,共拟同意47个申请项目进入特别审查程序,予以公示。

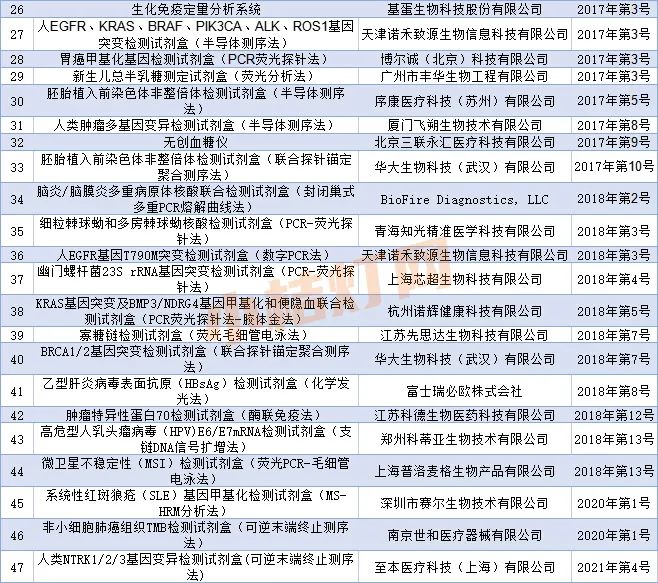
(点击可查看大图)
国家药监局积极贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),高度重视鼓励医疗器械创新发展,于2018年修订发布了《创新医疗器械特别审查程序》。该程序对具有我国发明专利、技术上具有国内首创、国际领先水平、并且具有显著临床应用价值的医疗器械设置了特别审批通道。对于经审查同意按该程序审批的创新医疗器械,国家药监局及相关技术机构,按照“早期介入、专人负责、科学审查”的原则,在标准不降低、程序不减少的前提下,予以优先办理。
截至2021年6月,国家药监局已批准22个IVD类创新医疗器械上市。
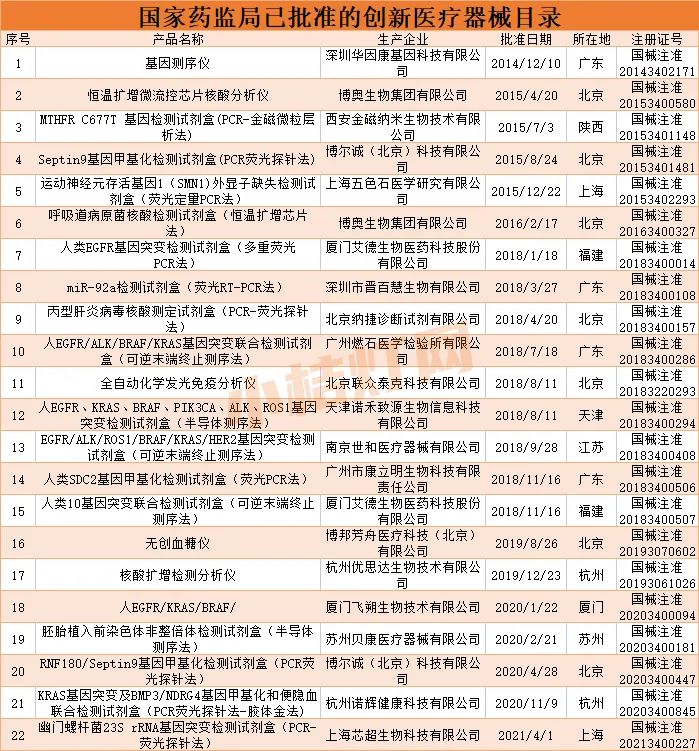
(点击可查看大图)
如需文档,可至小桔灯网(知识星球)下载。
—  —
—
点“在看”给我一朵小桔花




 个人中心
个人中心
 我是园区
我是园区








