2022年10月第四周医疗产业要闻
医
政
策
NMPA:新版药品召回管理办法明日施行
10月26日,国家药监局发布新修订《药品召回管理办法》,自11月1日起施行。药品召回,是指持有人按照规定的程序收回已上市存在质量问题或者其他安全隐患的药品,并采取相应措施,及时控制风险、消除隐患的活动。
其中,质量问题或者其他安全隐患,是指由于研制、生产、储运、标识等原因药品不符合法定要求,或者其他可能使药品具有危及人体健康和生命安全的不合理危险。包括药品研制、生产、储运、标识等原因,不符合药品生产质量管理规范(GMP)、《药品经营质量管理规范》(GSP)等现行药品质量管理规范要求,以及标签说明书不完善等导致的质量问题或者其他安全隐患。
对有证据证明可能危害人体健康,而被药品监督管理部门根据《药品管理法》的规定依法查封、扣押的药品,不属于本《办法》召回范围。
河北将启动OK镜、球囊等20种医用耗材集采
10月26日,河北省医保局发布通知,将开展20种集采医用耗材产品信息填报工作。涉及角膜塑形镜即的“OK镜”等内容引发关注列。
OK镜是一种用于矫正近视的隐形眼镜,是三类医疗器械,价格长期居高不下,每副需万元以上,且不在医保报销范围内。据悉,今年7月,国家卫建委曾发布一份征求意见稿,取消了验配OK镜要求二级以上医疗机构的条件限制,随着验配机构松绑,预计OK镜渗透率将加速提升。
广东、江西、湖北:心脏起搏器三省集采
10月26日,广东省药品交易中心发布《关于征求〈心脏起搏器类医用耗材联盟集中带量采购文件〉意见的通知》。采购联盟由广东、江西、湖北组成,采购周期自中选执行日起至2024年年底。
据《通知》,集采品种为起搏器、除颤器两种及其配套导线。起搏器、除颤器选用单腔、双腔、三腔三种。规则采用之前冠脉药物球囊接续集采时的梯级模式,量价挂钩。同类别以医疗器械注册证为单位,企业按3个梯级分别进行报价、报量,企业报价需按正整数申报价格。报价从高到低分为P1、P2、P3,分别对应采购量小于L1、L1至L2、大于L2三个等级。
值得注意的是,这次集采广东联盟首推增量概念,即协议采购量以外的量。同类别拟中选注册证按P1从低到高排序,排名前50%的注册证纳入增量适用范围。
工信部、药监局:公布人工智能医疗器械创新任务
10月26日,工业和信息化部办公厅、国家药品监督管理局综合和规划财务司公布人工智能医疗器械创新任务揭榜入围单位,总计231个人工智能项目入选创新任务。
相关文件中将未来重点突破的人工智能项目归为“智能辅助诊断产品”“智能辅助治疗产品”“智能监护与生命支持产品”“智能康复理疗产品”“智能中医诊疗产品”“医疗人工智能数据库”“人工智能医疗器械临床试验平台”“人工智能医疗器械真实世界数据应用平台”8类,每个入选项目再度划分揭榜单位与潜力单位,前者承担迅速落地的任务,产品相对成熟,后者仍处于发展中,有潜力成为未来医疗AI的主流。
CDE发布HPV疫苗临床试验设计征求意见稿
10月26日,中国国家药监局药品审评中心(CDE)发布《人乳头瘤病毒疫苗临床试验技术指导原则(征求意见稿)》,以指导企业规范研发人乳头瘤病毒(HPV)疫苗,加快相关产品上市。征求意见时限为自发布之日起1个月。
指导原则适用于拟在中国上市注册、以HPV主要衣壳蛋白L1组装为VLP的预防用疫苗;其它类型的预防用HPV疫苗(如以次要衣壳蛋白L2为靶点的预防用疫苗、嵌合VLP疫苗等)可参考执行。本指导原则不适用于治疗性HPV疫苗。
NMPA:鼓励艾滋自检试剂申报上市
10月25日,国家药监局发布答复函,明确表示,“符合相关创新或优先程序的艾滋病自检产品,可申请纳入相关程序”。
据介绍,截至目前,有两种用于患者自测的HIV1型尿液抗体检测试剂盒获批,分别为胶体金法和荧光免疫法。今年,药监局计划启动《人类免疫缺陷病毒自测试剂临床试验技术审评要点》制定工作,对自检试剂进一步明确要求。关于创新和临床急需医疗器械产品审批方面,截至目前,已有近400个产品进入创新医疗器械通道,167个已获批上市。
大
公
司
罗氏眼科双抗新药两项Ⅲ期临床达主要终点
10月27日,罗氏(Roche)宣布,其眼科双特异性抗体疗法Vabysmo(faricimab)在两项分别针对视网膜分支静脉阻塞和视网膜中央静脉阻塞的全球Ⅲ期临床试验中达到主要研究终点。
视网膜静脉阻塞(RVO)是视网膜血管疾病导致视力丧失的第二大常见原因。RVO中血管生成素2(Ang-2)的水平升高,并且认为增加的Ang-2表达驱动了疾病进展。RVO有两种主要类型:视网膜分支静脉阻塞(BRVO)和视网膜中央静脉阻塞(CRVO)。Vabysmo是一种双特异性抗体,它可以同时靶向阻断两条关键致病通路——Ang-2和血管内皮生长因子-A(VEGF-A)。
先声药业抗PD-L1/IL-15双抗在美国获批临床
10月27日,先声药业发布公告称,其自主研发的抗PD-L1/IL-15双特异性抗体SIM0237注射液新药临床试验申请(IND)获美国FDA批淮,拟用于治疗局部晚期不可切除或转移性实体瘤。不久前,该产品刚在中国递交临床试验申请,拟探索治疗晚期实体瘤患者的临床应用。
SIM0237可通过结合PD-L1阻断PD-1/L1免疫抑制通路,同时通过IL-15激活免疫系统,从而起到了解除免疫抑制和激活免疫系统的双重协同作用,发挥抗肿瘤作用。
强生全球首款靶向BCMA/CD3双抗在美国获批
10月25日,强生制药官网显示,FDA已批准其BCMA/CD3双抗Teclistamab在美国上市,用于治疗成人复发或难治性多发性骨髓瘤。
多发性骨髓瘤是血液系统里第二常见的恶性肿瘤,发病一般在老年人群。血液瘤中,它的发病率仅次于弥漫大B细胞淋巴瘤。强生的Teclistamab是全球首款靶向BCMA/CD3双抗,据报道,Teclistamab的月治疗费用为39500美元。
强生之后,辉瑞的同靶点药物Elranatamab正处于Ⅲ期临床,国内药企百济神州、信达生物、和铂医药等均有布局。
10月26日,强生集团旗下杨森公司宣布,美国FDA已经加速批准同时靶向B细胞成熟抗原(BCMA)和CD3受体的双特异性抗体Tecvayli(teclistamab)上市,用于治疗复发/难治性多发性骨髓瘤(RRMM)成人患者。
信达生物PI3Kδ抑制剂拟纳入优先审评
10月25日,CDE官网公示,信达生物parsaclisib片拟纳入优先审评,拟定适应症为:适用于既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤成人患者。此前,该产品针对上述适应症已被CDE纳入突破性治疗品种。
公开资料显示,作为一款针对PI3Kδ的新型口服抑制剂,parsaclisib对于抑制PI3Kδ在恶性B细胞淋巴瘤的生长、存活中起到重要作用。
安斯泰来布局中枢神经系统遗传病基因疗法
10月24日,安斯泰来和基因疗法新锐Taysha Gene Therapies宣布达成一项战略投资合作。安斯泰来将投资5000万美元获得Taysha公司15%的股权,以及对后者两款中枢神经系统(CNS)遗传病基因治疗项目的独家选择权。根据新闻稿,这两款基因治疗项目现处于临床阶段,拟开发适应症分别为Rett综合征、巨轴索神经病(GAN)。
TSHA-102是一种鞘内递送的AAV9基因替代疗法,正在开发用于治疗Rett综合征;TSHA-120是一种鞘内给药的AAV9基因替代疗法,拟开发用于治疗巨轴索神经病(GAN),目前正在海外进行Ⅰ/Ⅱ期临床试验。
医
快
讯
2022年盖伦奖揭晓
10月28日,美国盖伦基金会宣布了2022年盖伦奖的获奖名单。素有“医药界的诺贝尔奖”之称的盖伦奖被公认为是医药和生物医疗行业的最高荣誉,它表彰为改善人类健康做出的杰出科学创新。今年共有144个产品或公司获得提名,涵盖14个治疗领域。
奖项包括最佳生物技术产品奖、最佳药品奖、最佳医疗技术产品奖和最佳数字健康产品奖。它们均为最近5年内获得美国FDA批准上市,并且有潜力对人类健康产生重大影响的产品。值得注意的是,今年的盖伦基金会还颁发了最佳孵化器/加速器/投资者奖和最佳初创公司奖。
阿斯利康AKT抑制剂与下一代雌激素受体降解药物达试验主要终点
10月28日,阿斯利康公布两项乳腺癌试验的积极结果。数据显示,AKT激酶抑制剂capivasertib组合疗法与下一代选择性雌激素受体降解药物(ngSERD)camizestrant,能够分别改善试验中的局部晚期或转移性乳腺癌患者的无进展生存期(PFS)。
根据新闻稿,capivasertib具有成为潜在“first-in-class”治疗激素受体(HR)阳性乳腺癌患者疗法的潜力,而camizestrant的临床Ⅲ期则即将展开。
药明巨诺与2seventy bio达成合作,加速T细胞免疫治疗研发
10月27日,上海药明巨诺生物科技有限公司发布公告,公司已与2seventy bio订立合作协议。
据此,药明巨诺与2seventy bio有条件同意建立战略联盟,在大中华开发及商业化用于肿瘤适应症的针对MAGE-A4(包括与MAGE-A4结合的工程TCR的任何突变、片段、变型或衍生物)的细胞治疗产品,且有可能扩大合作,纳入其他项目及其他产品。
口服微生物疗法上市申请获FDA优先审评
10月26日,Seres Therapeutics宣布,FDA已受理口服微生物菌群疗法SER-109的生物制品许可申请(BLA),用于预防复发性艰难梭菌感染(rCDI),并授予其优先审查资格,PDUFA日期为2023年4月26日。
SER-109是一种基于细菌孢子的口服微生物菌群疗法,从健康人粪便纯化而来,平均含有大约50种细菌,通过重建肠道菌群,抑制艰难梭菌的生长。SER-109的纯化过程旨在去除不需要的微生物,从而降低病原体传播的风险。此前,FDA已授予SER-109突破性疗法认定和孤儿药称号。
上海启动吸入式新冠疫苗接种
10月26日,吸入式新冠疫苗作为加强针在上海正式开打,只打了两针的市民,第三针可选择使用吸入用重组新冠病毒疫苗(5型腺病毒载体)。媒体报道称,免疫持久性方面,使用吸入用重组新冠病毒疫苗异源接种6个月后,依旧保持了高水平中和抗体;安全性方面,吸入用重组新冠病毒疫苗在18岁以上人群中使用安全性良好,未发现严重不良反应。
使用方式上,吸入式新冠疫苗接种,主要包括雾化和吸入两部分,疫苗液被雾化为细小的颗粒注入雾化杯后,接种者须在15秒内完成口含深吸,并憋气至少5秒。整个过程不到一分钟。接种了吸入式新冠疫苗的不少市民普遍反映,整个过程还是让人很容易接受的,吸入的感觉就像“喝奶茶”,味道甚至还“有点甜”。与肌肉注射的新冠疫苗相似,吸入式疫苗接种后,同样需要在接种点留观30分钟。
投
融
资
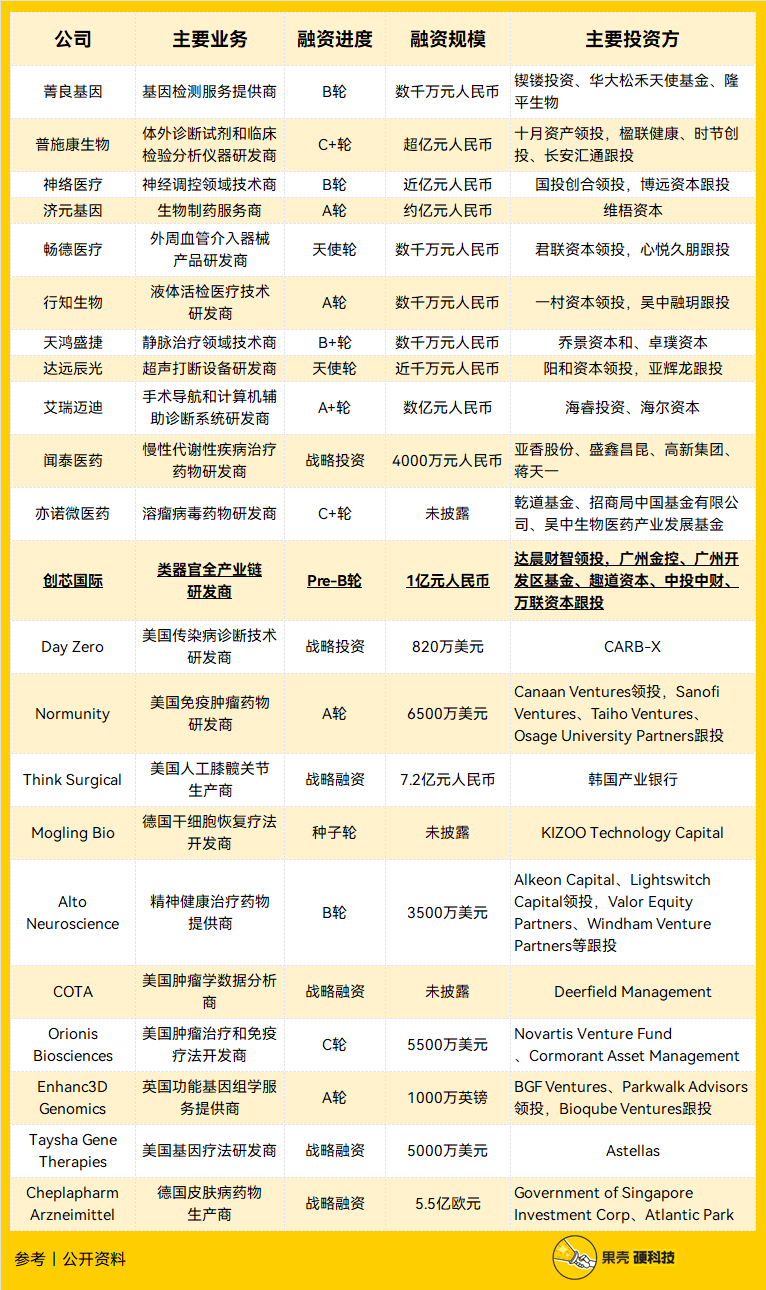
创芯国际Pre-B轮1亿元,继续领跑类器官赛道
10月28日,创芯国际生物科技(广州)有限公司宣布完成1亿元人民币Pre-B轮融资。本轮融资将继续加大对核心技术及产品的研发、人才的投入,构建类器官全生命周期技术平台,推动核心技术的突破升级,专注类器官生物材料、类器官芯片、人工智能系统等形成产品矩阵及产业链的布局。
创芯国际是一家以类器官为核心技术的创新型生物医疗企业,下设中欧类器官研究院、临床第三方检测中心。目前,创芯已经拥有多项类器官专利,业务覆盖全国多个省区,主要提供类器官培养检测系统以及新药研发。
艾瑞迈迪A+轮数亿元,深耕增强现实精准导航智能领域
10月25日,艾瑞迈迪医疗科技(北京)有限公司完成数亿元A+轮融资。本轮融资主要应用于科研合作及临床试验、产品与技术的迭代升级、以及市场开拓,进一步巩固并扩大公司在智能化医疗领域的行业影响力。
艾瑞迈迪是一家手术导航和计算机辅助诊断系统研发商,主要从事智能医疗产品研发,通过搭建数字化手术环境,提供智能微创手术整体解决方案,为各级医疗机构提供临床数据共享与远程医疗服务。
神络医疗B轮近亿元,多项神经调控创新器械取得突破进展
10月24日,杭州神络医疗科技有限公司完成近亿元B轮融资。本轮融资将用于新产品研发、临床研究、注册申请以及芯片迭代等方面。
神络医疗专注于植入类神经调控领域医疗器械自主研发和生产,以持续为医生和患者提供更先进、更有效的治疗手段为己任,致力于改善更多难治型患者的生活质量。
达远辰光天使轮近千万元,提供样品前处理整体解决方案
10月25日,深圳达远辰光科技有限公司完成近千万元天使轮融资。本轮融资将用于完善产品布局、加大市场投入以及新厂房和团队建设。
达远辰光聚焦于满足未来先进实验室需求的诊断研究和分子生物学综合解决方案,推出了中国首套聚焦超声样品处理系统、全球独家流式真空脱气系统、实验室耗材以及蛋白质生物制品等多项技术领先产品,为不断发展的生物学研究提供更先进的科研及临床整体实验室解决方案。
普施康生物C+轮过亿元,加速微流控POCT平台化企业布局
10月24日,浙江普施康生物科技有限公司完成过亿元C+轮融资。本轮融资将进一步加速普施康离心微流控平台产品围绕危急重症+慢病管理进行管线拓展,加快海外销售布局,在研拳头产品免疫生化凝血一体机的落地将为POCT市场带来革新力量。
普施康生物是一家体外诊断试剂和临床检验分析仪器研发商,利用微流控盘式芯片平台技术,结合独创的微量全血分离功能,主要为用户提供适用国情的凝血、免疫、分子诊断试剂盒及新型配套检测系统,适用于大医院急诊、中小医院、临床科室、社区医院和移动医疗的体外诊断领域。

★
贝
壳
社
★
关注公众号
了解更多医疗资讯

声明:本文不构成任何投资建议,且非治疗方案推荐。




 个人中心
个人中心
 我是园区
我是园区