您还不是认证园区!
赶快前去认证园区吧!


非临床生物分布(简称BD)是基因治疗(简称GT)产品药代动力学(PK)研究的重要组成部分,是指基因治疗产品在生物学相关动物中给药部位、靶组织和非靶组织包括体液(例如,血液、脑脊液、玻璃体液)在内的体内分布、存续和清除。非临床BD研究包括分析方法的使用,以检测样本中的基因治疗产品和所转导的遗传物质,也可包括用于检测所转导的遗传物质的表达产物的方法。目前全球各监管机构对基因治疗产品的生物分布研究可能有不同的要求,为基因治疗产品的开发带来了挑战。2018年6月,国际药物监管计划(IPRP)的基因治疗工作组编写了Expectations for Biodistribution Assessments for Gene Therapy Products 意见书,该文件代表了当前不同的药品监管机构对支持基因治疗产品进入临床试验和上市申请时需要开展的非临床生物分布研究的认识,重点讨论了支持首次临床试验的生物分布研究、试验设计需考虑因素以及允许在首次临床试验后开展生物分布研究的情况2021年6月3日;ICH相关章程要求,发布S12《基因治疗产品非临床生物分布考虑》专家共识。
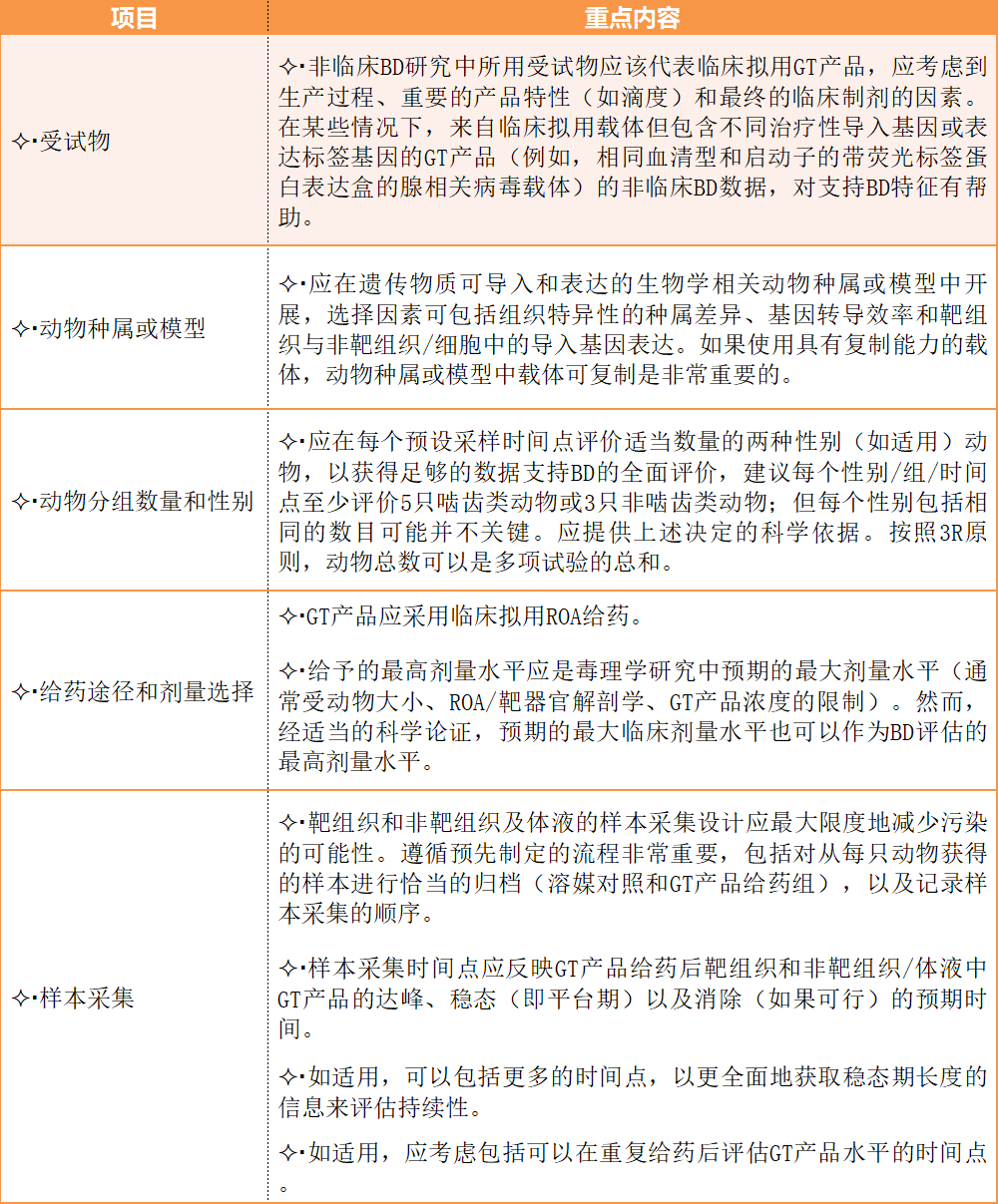
二、非临床生物分布研究重点内容
ICH制定《基因治疗产品非临床生物分布考虑》指导原则,目的是为基因治疗产品研发中开展非临床生物分布研究提供协调一致的建议。本指导原则为非临床生物分布研究的整体设计提供了建议,也提供了解释和应用生物分布数据以支持非临床研发计划和临床试验设计的考虑。本指导原则中的建议旨在促进基因治疗产品的研发,同时遵循3R原则(减少/优化/替代),避免不必要的动物使用。

参考文献





 个人中心
个人中心
 我是园区
我是园区




