Science | 赵祥揭示利用逆锁键精准调控T细胞受体的活性应用于肿瘤免疫治疗
收藏
关键词:
Science揭示
资讯来源:BioArt + 订阅账号
发布时间:
2022-04-23

T细胞受体
(T cell receptor,
TCR
)
识别其配体短肽-主要组织相容性复合物
(peptide-major histocompatibility complex,
pMHC
)
,这一蛋白相互作用决定了T细胞的抗原特异性和激活强度。在肿瘤免疫治疗中,识别肿瘤特异抗原pMHC的TCR 可以被用于细胞治疗,但是内源性的TCR对肿瘤抗原pMHC的激活应答水平往往较低。
为了提高TCR的激活强度,传统方法是利用亲和力成熟这一项技术,通过数千数万倍地提高TCR结合抗原pMHC的亲和力(
KD
),来提高TCR的激活水平
。亲和力成熟的方法在众多细胞治疗的临床试验中被证明是有效的,但也存在一些问题,例如过高的KD可能会导致TCR失去抗原识别的特异性:TCR不仅识别特异的肿瘤抗原,也开始识别健康组织中的抗原,即脱靶毒性。KD被认为是决定TCR激活水平的重要生物化学指标,但研究者也在众多特例中发现KD不一定与TCR的激活水平呈正相关,说明还有其他因素决定着TCR的激活,例如逆锁键
(catch bond)
。如何不依赖KD的提高、获得拥有低水平的KD和高水平的激活强度的TCR,可能是解决TCR用于细胞治疗中产生的脱靶毒性的重要方法。
2022年4月8日,来自斯坦福大学的K. Christopher Garcia实验室在Science上以Research Article发表了题为
Tuning T cell receptor sensitivity through catch bond engineering
的研究成果。
该研究揭示了TCR的激活伴随着TCR和pMHC之间逆锁键的形成,并且TCR的激活水平与逆锁键的键寿命峰值
(peak bond lifetime)
呈正相关;TCR的工程化可以通过富集逆锁键获得低KD,高激活水平的TCR,将这一逆锁键工程技术应用于黑色素瘤抗原特异的TCR获得了高激活水平的TCR突变体,并且新的突变体不再有以往临床试验中报道过的因亲和力成熟而导致的攻击病人心脏的脱靶毒性。
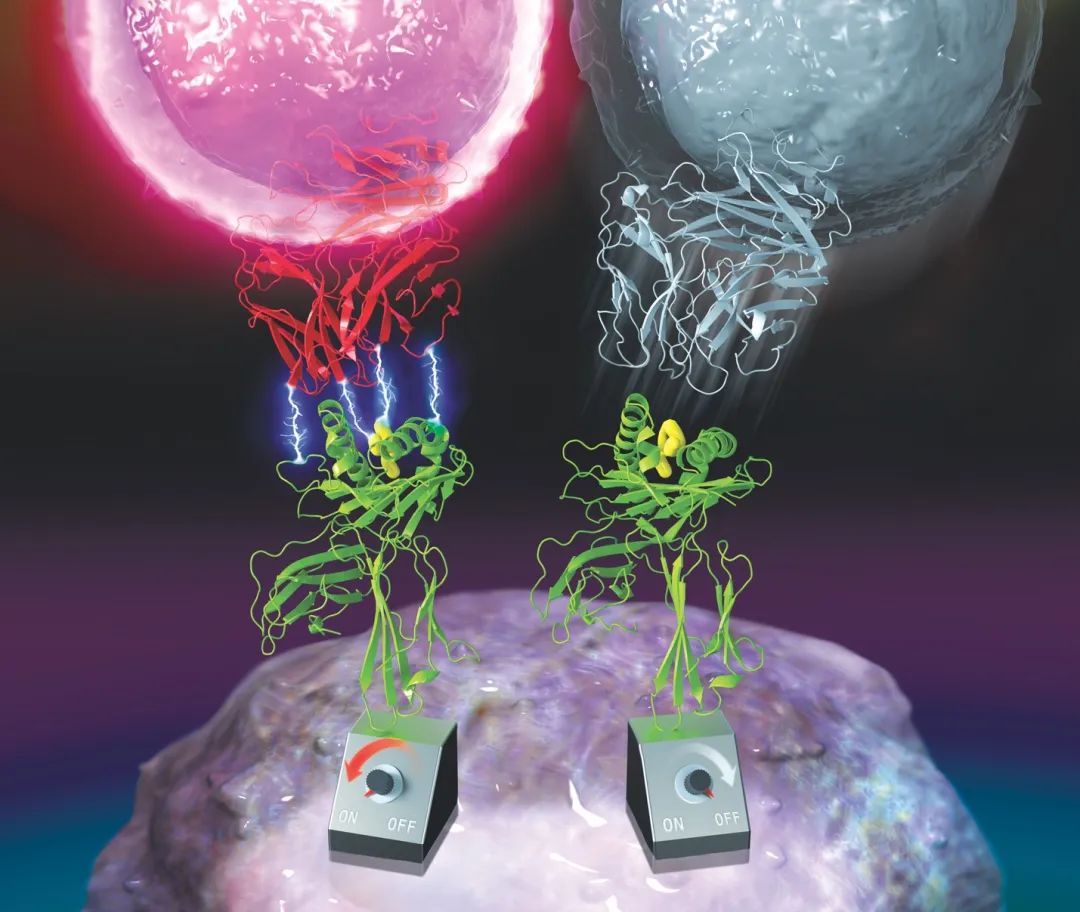
逆锁键(catch bond)是一种由外力导致的非共价相互作用,描述一些蛋白质之间相互作用时的一种“反常”现象,即在pN量级的剪切拉力的影响下,蛋白质之间的键寿命
(bond lifetime)
随着施加拉力的强度增加而延长,蛋白质之间不仅没有解离反而被外力锁定为束缚状态。与逆锁键相对应的是滑移键
(slip bond)
,即蛋白质之间的键寿命随着施加拉力的强度增加而减短。逆锁键和滑移键共同组成一对分子开关,调节生理活动中一些蛋白质的相互作用,如大肠杆菌对尿道的黏附、白细胞对于感染区域附近内皮细胞的黏附、TCR-pMHC相互作用、Notch信号通路的激活、肌动蛋白肌球蛋白相互作用与微丝解聚等。
K. Christopher Garcia实验室在过去的研究中,发现一种HIV来源的抗原短肽
(HIV)
,与B35 MHC形成复合物
(B35-HIV)
后,B35-HIV与两种TCR
(TCR589和TCR55)
有着类似的结合亲和力KD;B35-HIV可以激活TCR589,但无法激活TCR55,说明KD无法解释为何TCR55可以结合其特异性的配体,但是无法开启TCR信号。生物膜力学探针
(biomembrane force probe,
BFP
)
实验发现B35-HIV 可以与TCR589形成逆锁键,但与TCR55形成滑移键,说明逆锁键不仅是TCR激活所必需的,另外TCR可能可以通过逆锁键的转化与形成,获得KD变化有限、但激活强度明显增加的TCR突变体。
作者首先假设可以通过突变TCR的互补决定区
(complementarity determining regions,
CDRs
)
的一些残基成为带电荷或者极性的氨基酸,在TCR-pMHC的相互作用中产生新的逆锁键。这些被选中的残基一般距离pMHC至少0.4纳米,从而防止过度富集亲和力成熟的突变体。TCR文库通过慢病毒转导展示在T细胞系上,经过抗原刺激后,对展示TCR文库的T细胞进行CD69抗体染色来标记不同TCR突变体的激活强度、pMHC四聚体染色来标记不同TCR突变体结合pMHC的亲和力。接着,对T细胞文库进行分选,为了获得因富集逆锁键而产生的低KD,高激活水平的TCR突变体,分选的目标区域为CD69抗体染色高水平、pMHC四聚体染色低水平。
 作者首先通过设计TCR55文库并进行功能筛选
(functional selection)
,获得了两个不同的TCR55突变体:一个突变体仅有TCR55 链第98位残基丙氨酸突变成组氨酸这一个突变,另一个突变体仅有TCR55 链第50位残基丙氨酸突变成天冬氨酸这一个突变。这两个单氨基酸突变体均能被B35-HIV激活,并且保持结合B35-HIV的KD在野生型TCR55的水平。BFP实验发现其机制为滑移键在突变体中均被转化成了逆锁键。另外,作者发现TCR55 链第98位残基和TCR55 链第50位残基是进行逆锁键工程的热点残基,因为这两个残基还能允许多种其他极性或带电荷氨基酸突变形成逆锁键并被B35-HIV激活。进一步研究发现不同TCR55突变体的激活水平与KD不相关,但是与逆锁键形成过程中的键寿命峰值呈正相关,说明可以通过调节键寿命峰值来精准调节TCR的激活水平。作者通过一种Jurkat T细胞信号通路报告系统证明逆锁键工程改造的TCR55突变体可以正常激活ERK, p38, NFAT等下游信号通路。另外,作者还通过一种“智慧珠子”平台技术BATTLES
(Biomechanically-Assisted T-cell Triggering for Large-scale Exogenous-pMHC Screening)
,将生理浓度条件下的B35-HIV镀在智慧珠子上,智慧珠子通过在不同温度条件下改变尺寸大小对黏附其上的T细胞施加外力,从而模拟逆锁键的形成并激活T细胞,证明了逆锁键工程改造的TCR55突变体也可以被生理浓度下的pMHC激活。
为了验证逆锁键工程是否可以应用于肿瘤抗原特异的TCR并且不产生脱靶毒性,作者选取了一个较知名的细胞治疗失败案例:黑色素瘤抗原MAGE-A3的特异性野生型TCR经过亲和力成熟后,获得了一个亲和力提高数百倍、激活强度大大增强的突变体A3A TCR。A3A TCR在临床试验中引起了两位病人的死亡,死因为心脏中发现大量T细胞浸润和心脏损伤。研究发现A3A TCR产生了脱靶毒性,不仅识别肿瘤抗原MAGE-A3,还识别心脏表达的蛋白质TITIN来源的短肽,从而引起了A3A TCR对于心脏的攻击。作者基于野生型TCR设计了文库并进行了功能筛选,获得13种不同的均能被MAGE-A3激活的TCR突变体,并且这些突变体均不能被TITIN激活。这13种突变体结合MAGE-A3的KD均比A3A要低10-50倍,但是结合TITIN的KD已低到无法测出,说明脱靶毒性被移除的机理之一是这些TCR突变体不再结合TITIN。作者选取了其中两种TCR突变体
(94a-14和20a-18)
做进一步研究,发现均能与MAGE-A3形成逆锁键,但与TITIN仅形成滑移键,说明脱靶毒性被移除的另一机理是逆锁键/滑移键的转化。这两种TCR突变体的激活强度仍然与键寿命峰值呈正相关,并且在原代T细胞中仍表现出了和A3A TCR几乎接近的肿瘤细胞杀伤能力。为了进一步排除因逆锁键工程改造引入其他未知蛋白的脱靶毒性,作者通过酵母展示技术构建了peptide-HLA-A1文库,筛选任何可以结合TCR突变体的短肽,并进行生物信息学预测哪些自身蛋白质短肽可能激活这些TCR突变体。筛选结果发现对于亲和力成熟的A3A TCR,不仅MAGE-A3和TITIN被高排位预测为可以激活A3A TCR的短肽,作者还发现了MAGE-A6、FAT2其他两种可能的脱靶毒性蛋白短肽。然而对于逆锁键工程改造的TCR突变体,只有肿瘤抗原MAGE-A3被高排位预测为可以激活TCR突变体的短肽,其他预测短肽均不能激活,并且TITIN已不再出现在预测清单中。
综上所述,作者通过深入研究TCR激活的机理,进一步阐明了逆锁键形成对于TCR激活的重要性,并且发现可以通过调节键寿命峰值精准调控TCR激活水平。基于此,作者进一步证明了逆锁键是可以被工程化改造的生物物理指标,通过富集逆锁键,可以在不大幅提高结合亲和力的情况下,大幅提高抗原pMHC对于TCR的激活水平。这一发现可以被利用于肿瘤特异的TCR的工程化改造中,并进一步利用于过继性细胞治疗和肿瘤免疫治疗中。
斯坦福大学的赵祥博士为该研究论文的第一作者,K. Christopher Garcia教授为通讯作者。犹他大学的Brian Evavold教授、Elizabeth Kolawole博士,NIH的Ronald Germain教授、Waipan Chan博士,斯坦福大学的Polly Fordyce教授、冯寅年博士、杨鑫博博士等做出了重要贡献。
https://www.science.org/doi/10.1126/science.abl5282
作者首先通过设计TCR55文库并进行功能筛选
(functional selection)
,获得了两个不同的TCR55突变体:一个突变体仅有TCR55 链第98位残基丙氨酸突变成组氨酸这一个突变,另一个突变体仅有TCR55 链第50位残基丙氨酸突变成天冬氨酸这一个突变。这两个单氨基酸突变体均能被B35-HIV激活,并且保持结合B35-HIV的KD在野生型TCR55的水平。BFP实验发现其机制为滑移键在突变体中均被转化成了逆锁键。另外,作者发现TCR55 链第98位残基和TCR55 链第50位残基是进行逆锁键工程的热点残基,因为这两个残基还能允许多种其他极性或带电荷氨基酸突变形成逆锁键并被B35-HIV激活。进一步研究发现不同TCR55突变体的激活水平与KD不相关,但是与逆锁键形成过程中的键寿命峰值呈正相关,说明可以通过调节键寿命峰值来精准调节TCR的激活水平。作者通过一种Jurkat T细胞信号通路报告系统证明逆锁键工程改造的TCR55突变体可以正常激活ERK, p38, NFAT等下游信号通路。另外,作者还通过一种“智慧珠子”平台技术BATTLES
(Biomechanically-Assisted T-cell Triggering for Large-scale Exogenous-pMHC Screening)
,将生理浓度条件下的B35-HIV镀在智慧珠子上,智慧珠子通过在不同温度条件下改变尺寸大小对黏附其上的T细胞施加外力,从而模拟逆锁键的形成并激活T细胞,证明了逆锁键工程改造的TCR55突变体也可以被生理浓度下的pMHC激活。
为了验证逆锁键工程是否可以应用于肿瘤抗原特异的TCR并且不产生脱靶毒性,作者选取了一个较知名的细胞治疗失败案例:黑色素瘤抗原MAGE-A3的特异性野生型TCR经过亲和力成熟后,获得了一个亲和力提高数百倍、激活强度大大增强的突变体A3A TCR。A3A TCR在临床试验中引起了两位病人的死亡,死因为心脏中发现大量T细胞浸润和心脏损伤。研究发现A3A TCR产生了脱靶毒性,不仅识别肿瘤抗原MAGE-A3,还识别心脏表达的蛋白质TITIN来源的短肽,从而引起了A3A TCR对于心脏的攻击。作者基于野生型TCR设计了文库并进行了功能筛选,获得13种不同的均能被MAGE-A3激活的TCR突变体,并且这些突变体均不能被TITIN激活。这13种突变体结合MAGE-A3的KD均比A3A要低10-50倍,但是结合TITIN的KD已低到无法测出,说明脱靶毒性被移除的机理之一是这些TCR突变体不再结合TITIN。作者选取了其中两种TCR突变体
(94a-14和20a-18)
做进一步研究,发现均能与MAGE-A3形成逆锁键,但与TITIN仅形成滑移键,说明脱靶毒性被移除的另一机理是逆锁键/滑移键的转化。这两种TCR突变体的激活强度仍然与键寿命峰值呈正相关,并且在原代T细胞中仍表现出了和A3A TCR几乎接近的肿瘤细胞杀伤能力。为了进一步排除因逆锁键工程改造引入其他未知蛋白的脱靶毒性,作者通过酵母展示技术构建了peptide-HLA-A1文库,筛选任何可以结合TCR突变体的短肽,并进行生物信息学预测哪些自身蛋白质短肽可能激活这些TCR突变体。筛选结果发现对于亲和力成熟的A3A TCR,不仅MAGE-A3和TITIN被高排位预测为可以激活A3A TCR的短肽,作者还发现了MAGE-A6、FAT2其他两种可能的脱靶毒性蛋白短肽。然而对于逆锁键工程改造的TCR突变体,只有肿瘤抗原MAGE-A3被高排位预测为可以激活TCR突变体的短肽,其他预测短肽均不能激活,并且TITIN已不再出现在预测清单中。
综上所述,作者通过深入研究TCR激活的机理,进一步阐明了逆锁键形成对于TCR激活的重要性,并且发现可以通过调节键寿命峰值精准调控TCR激活水平。基于此,作者进一步证明了逆锁键是可以被工程化改造的生物物理指标,通过富集逆锁键,可以在不大幅提高结合亲和力的情况下,大幅提高抗原pMHC对于TCR的激活水平。这一发现可以被利用于肿瘤特异的TCR的工程化改造中,并进一步利用于过继性细胞治疗和肿瘤免疫治疗中。
斯坦福大学的赵祥博士为该研究论文的第一作者,K. Christopher Garcia教授为通讯作者。犹他大学的Brian Evavold教授、Elizabeth Kolawole博士,NIH的Ronald Germain教授、Waipan Chan博士,斯坦福大学的Polly Fordyce教授、冯寅年博士、杨鑫博博士等做出了重要贡献。
https://www.science.org/doi/10.1126/science.abl5282
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 药选址
药选址



