Nat Chem Biol | 王玉刚课题组报道组蛋白硫酸化修饰并揭示其功能机制
收藏
关键词:
Nat揭示
资讯来源:BioArt + 订阅账号
发布时间:
2023-02-21

责编 | 兮
组蛋白
(Histone)
是染色质的主要蛋白质组分,作为DNA缠绕的骨架,与DNA共同组成核小体结构,在遗传信息表达等染色质相关的生物学过程中发挥重要作用。正常生理条件下,组蛋白翻译后修饰是核小体结构和功能的重要调节机制,在基因表达、DNA复制、DNA损伤修复和染色质结构调节等过程中起重要作用。病理生理条件下,组蛋白翻译后修饰的失调与癌症等人类重大疾病的发生与发展过程密切相关。
2023年2月20日,华中科技大学同济基础医学院、华中科技大学细胞架构研究中心王玉刚教授团队和山东大学公共卫生学院刘珂教授团队在 Nature Chemical Biology合作发表题为
Histone tyrosine sulfation by SULT1B1 regulates H4R3me2a and gene transcription
的研究论文。
该研究揭示了硫酸转移酶SULT1B1直接催化组蛋白H3Y99位点硫酸化修饰(H3Y99sulf)的催化机制,阐明了H3Y99sulf在转录活跃区域的核小体亚结构表面招募PRMT1并调控组蛋白H4R3me2a和基因转录的功能机制。
团队首先用高分辨蛋白质质谱在细胞核提取物中发现组蛋白H3第99位酪氨酸残基的硫酸化修饰
(H3Y99sulf)
,证明Ysulf是尚未被报道的新型组蛋白修饰类型。真核细胞内,细胞质硫基转移酶家族
(SULTs)
成员SULT1B1在细胞质内直接用PAPS为底物催化新生组蛋白H3单体的H3Y99sulf修饰。被H3Y99sulf修饰的新生组蛋白H3在分子伴侣的帮助下与组蛋白H4形成异源二聚体,进入细胞核,在转录活跃区域被包装入染色质核小体。虽然组蛋白H3Y99位点被包埋在完整核小体八聚体内部,但转录活跃区域的核小体由于基因转录的需要而处于六聚体、四聚体、半核小体等亚结构状态,因此H3Y99sulf可暴露在核小体亚结构表面,招募蛋白质精氨酸甲基转移酶PRMT1,调控染色质转录活跃区域组蛋白H4R3me2a修饰,激活下游基因的转录,执行H3Y99sulf调控基因转录的功能
(图1)
。
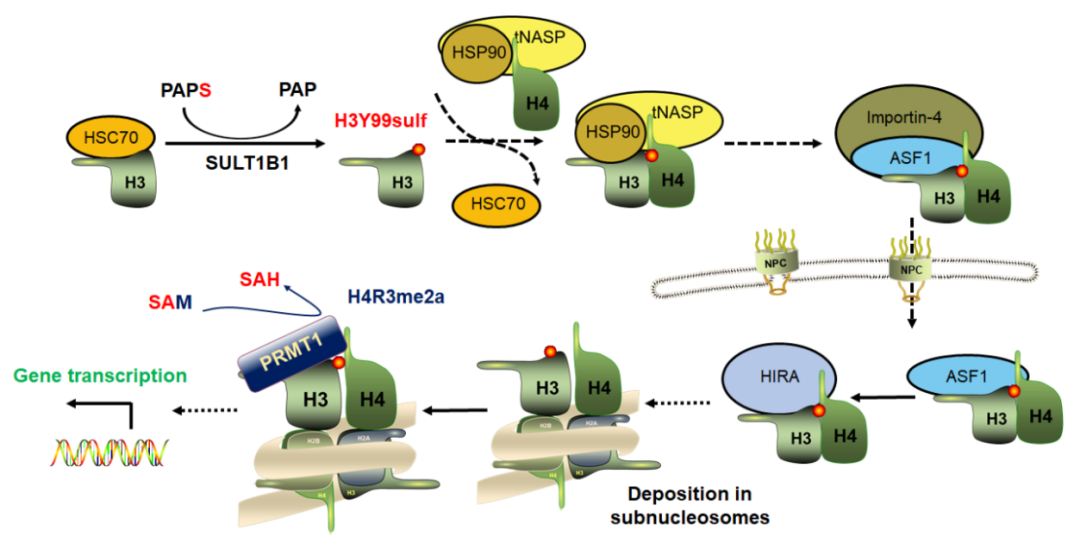
图1. H3Y99sulf的修饰和功能机制示意图。SULT1B1用PAPS为底物在细胞质内催化新生组蛋白H3发生H3Y99sulf修饰反应。被H3Y99sulf修饰的新生组蛋白H3在分子伴侣的帮助下与组蛋白H4形成异源二聚体,进入细胞核,被包装在转录活跃区域的染色质核小体中。H3Y99sulf被暴露在转录活跃区域的核小体亚结构表面,通过招募PRMT1使其周围区域发生H4R3me2a修饰,激活其所在启动子调控的基因转录,发挥基因转录调节的功能。
该研究率先发现了酪氨酸硫酸化修饰是组蛋白修饰的新类型,鉴定了SULT1B1催化组蛋白H3Y99sulf的修饰机制,发现了H3Y99sulf招募PRMT1并调控下游H4R3me2a修饰的功能机制,描绘了H3Y99sulf在染色质上的分布规律,阐明了H3Y99sulf调控代谢相关基因表达的生理功能。该工作拓展了组蛋白修饰图谱,丰富了组蛋白修饰调控遗传信息表达的功能网络,将蛋白质硫酸化修饰生理功能的相关研究从细胞外拓展到细胞核内,为研究细胞核内其它蛋白质的硫酸化修饰提供了重要参考。
华中科技大学同济基础医学院博士生余维星、周润心为该文的共同第一作者,华中科技大学同济基础医学院王玉刚教授、山东大学公共卫生学院刘珂教授为共同通讯作者。
华中科技大学同济基础医学院王玉刚教授团队专注于研究细胞代谢调控网络中蛋白质修饰的新类型、新机制、新功能。团队长期招聘博士后和技术员,热诚欢迎有细胞生物学、合成生物学和化学生物学等背景的人才加入。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
https://doi.org/10.1038/s41589-023-01267-9
制版人:十一

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。










 药选址
药选址







