Cell | 姜道华/郑宁/William Catterall合作报道首个开放状态真核钠通道结构
收藏
关键词:
Cell合作
资讯来源:BioArt + 订阅账号
发布时间:
2021-09-14
在可兴奋细胞中,电压门控钠离子通道
(Voltage-gated sodium channel, NaV1.1-1.9)
负责产生和传播动作电位。电压门控钠离子通道参与许多生理进程,例如神经信号传递、骨骼肌和心肌收缩、痛觉感知等。其中,NaV1.5作为心脏中最主要的钠离子通道,负责启动和维持心脏有节律地跳动。NaV1.5发生突变或功能异常会引起心律不齐,威胁人类的生命健康。因此,NaV1.5是临床上常用的一类抗心律不齐药物
(Class I Anti-arrhythmic Drug)
的直接靶点。鉴于NaV1.5在维持心脏有节律跳动中发挥了极其重要的作用,阐明NaV1.5的结构与功能的关系具有重大意义。过去几年研究人员陆续报道了高等生物NaV1.1、NaV1.2、NaV1.4、NaV1.5和NaV1.7高分辨率冷冻电镜
(cryo-EM)
三维结构
【1-6】
。然而由于高度的序列保守性,这些结构处于非常相似的失活态构象,在真核钠通道发挥功能过程中的静息态和开放态的结构依然未知。单通道电生理结果表明,真核钠离子通道开放是一种非常短暂的瞬时状态,通常不超过100微秒。所以,如何将真核钠通道稳定在开放状态并解析其结构非常具有挑战性。
2020年初,美国University of Washington的姜道华博士
(现为中国科学院物理研究所软物质实验室特聘研究员)
,与William A. Catterall教授和郑宁教授在Cell 发表题为
Structure of the cardiac sodium channel
的论文,首次报道了心肌细胞钠通道NaV1.5的结构,展示了临床药物分子与钠通道的相互作用
(详见BioArt报道:Cell | 郑宁课题组等解析鼠源NaV1.5结构)
。2021年1月,该团队在Nature Communications杂志发表题为
Structural basis for voltage-sensor trapping of the cardiac sodium channel by a deathstalker scorpion toxin
发文,该研究报道了NaV1.5结合蝎毒素LqhIII复合物结构,揭示了蝎毒素LqhIII的结合会把NaV1.5的第四个电压感应结构域稳定在一种中间态,从而弱化了IFM motif的结合,导致钠通道更倾向于打开
(详见BioArt报道:Nat Comm | 郑宁/姜道华团队揭示钠通道NaV1.5激活-失活偶联的结构基础)
。
2021年9月13日,姜道华研究员与美国University of Washington的William A. Catterall教授和郑宁教授合作在Cell杂志在线发表了题为
Open State Structure and Pore Gating Mechanism of the Cardiac Sodium Channel
的论文。作者通过筛选可以阻断钠通道快速失活的突变体,解析了钠通道突变体NaV1.5/QQQ处于开放状态的冷冻电镜结构,
揭示了抗心律不齐药物普罗帕酮(Propafenone)与开放状态钠通道的结合位点。结合分子动力学模拟和膜片钳电生理等手段,从原子水平上阐明了钠通道开放状态、钠通道开放状态的药物阻断以及钠通道快速失活的分子机制
。

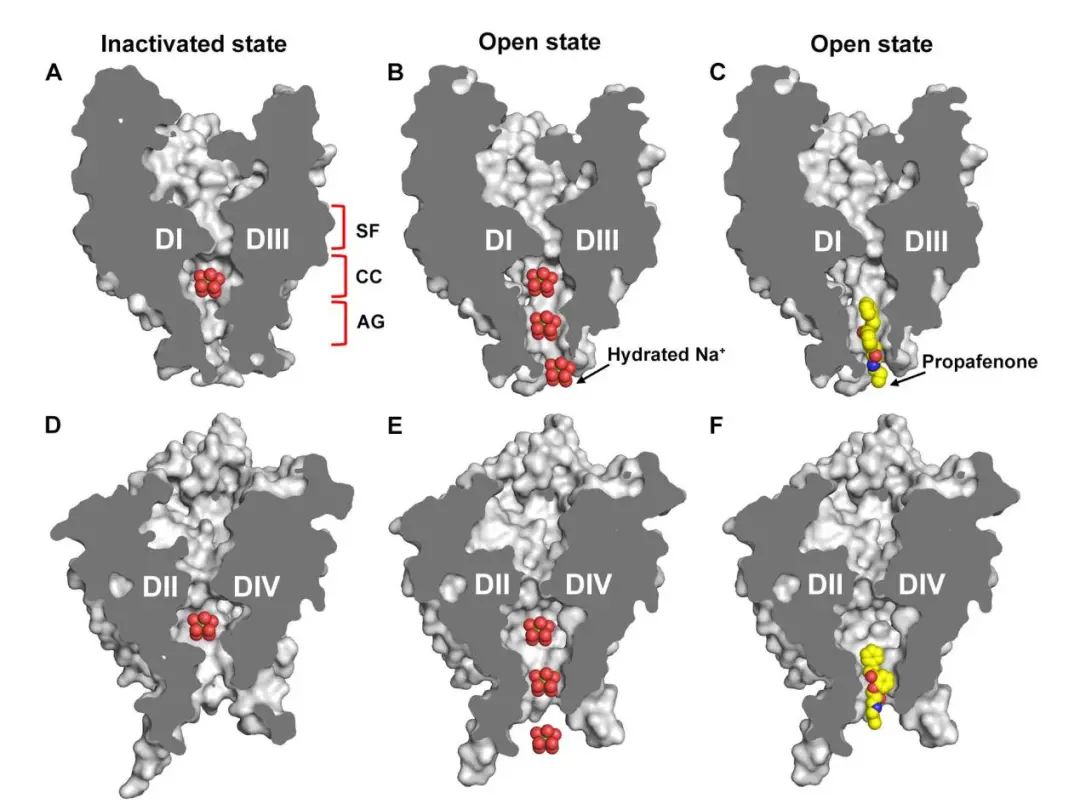
作者首先将突变IFM/QQQ引入NaV1.5,发现该突变能有效阻断钠通道的快速失活,所获得的突变体Nav1.5/QQQ在被激活后能长时间保持开放状态。为了克服NaV1.5/QQQ突变体在表达时因为持续激活导致的细胞毒性,作者筛选发现普罗帕酮可以有效缓解细胞毒性。随后作者利用冷冻电镜解析了高分辨率开放态钠通道的结构,从原子水平上揭示了钠通道快速打开、快速失活和开放态阻断的结构基础。与此前报道的NaV1.5结构相比,在NaV1.5/QQQ结构中,由于亲水性的QQQ脱离原本容纳疏水IFM 的疏水性结合口袋,导致胞内侧的激活门孔扩大。通过对比水合钠离子的大小,作者推测该门孔的直径足以让水合钠离子自由通过,从而判定该结构处于开放状态
(如图所示)
。
为了进一步验证所获得的NaV1.5/QQQ结构处于开放状态的假设。作者对NaV1.5、NaV1.5/LqhIII和NaV1.5/QQQ的结构进行了分子动力学模拟。发现NaV1.5/QQQ的激活门与NaV1.5、NaV1.5/LqhIII的不同,有一半以上的概率会处于充满水的状态,呈现出与此前报道的开放状态的原核钠通道NaVAb/1-226相似的双峰分布。更重要的是,通过分子动力学模拟计算出的开放状态NaV1.5/QQQ通透钠离子的传输速率与电生理单通道实验值相近。分子动力学模拟结果支持NaV1.5/QQQ结构处于开放状态。
类似于局部麻醉药物,抗心律不齐药物被认证为作为阻断剂结合在钠通道的中央腔中。作者发现,普罗帕酮可以穿过开放状态下NaV1.5的激活开口,到达中央腔的高亲和力结合位点,特异性地阻断NaV1.5。电生理结果表明,在有普罗帕酮的情况下,NaV1.5/QQQ激活后先达到最大电流,然后电流被抑制,说明普罗帕酮倾向于结合开放状态的钠通道。以上结果证实普罗帕酮是一种开放状态的阻断剂。
综上所述,
作者通过解析心肌细胞钠离子通道突变体NaV1.5/QQQ开放状态以及其与抗心律不齐药物普罗帕酮复合物结构,阐释了钠离子通道开放状态和快速失活的机制,为理解抗心律不齐药物如何阻断开放状态的NaV1.5以及开发新的抗心律不齐药物奠定了基础。
中国科学院物理研究所软物质实验室姜道华研究员为该研究的第一及共同通讯作者,姜道华课题组计划利用物理所电镜平台
(Titan 300 kv-Energy filter-K3 camera, Glacios 200 kv-K3 camera)
,结合生物化学,电生理以及分子动力学模拟等手段,研究生命活动中发挥重要功能的膜蛋白结构和发挥功能的分子机制。实验室招收博士研究生,长期招聘联合培养学生,博士后和研究助理。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
https://doi.org/10.1016/j.cell.2021.08.021
1. Shen, H. et al. Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. Science 355, eaal4326 (2017).
2. Pan, X. et al. Structure of the human voltage-gated sodium channel Nav1. 4 in complex with β1. Science 362, eaau2486 (2018).
3. Shen, H. et al. Structures of human Nav1.7 channel in complex with auxiliary subunits and animal toxins. Science 363, aaw2493 (2019).
4. Pan, X. et al. Molecular basis for pore blockade of human Na+ channel Nav1.2 by the μ-conotoxin KIIIA. Science, eaaw2999 (2019).
5. Jiang, D. et al. Structure of the cardiac sodium channel. Cell 180 (1), 122-134 (2020).
6. Jiang, D. et al. Structural basis for voltage-sensor trapping of the cardiac sodium channel by a deathstalker scorpion toxin. Nat Commun 12, 128 (2021).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。





 药选址
药选址



