▎药明康德内容团队报道
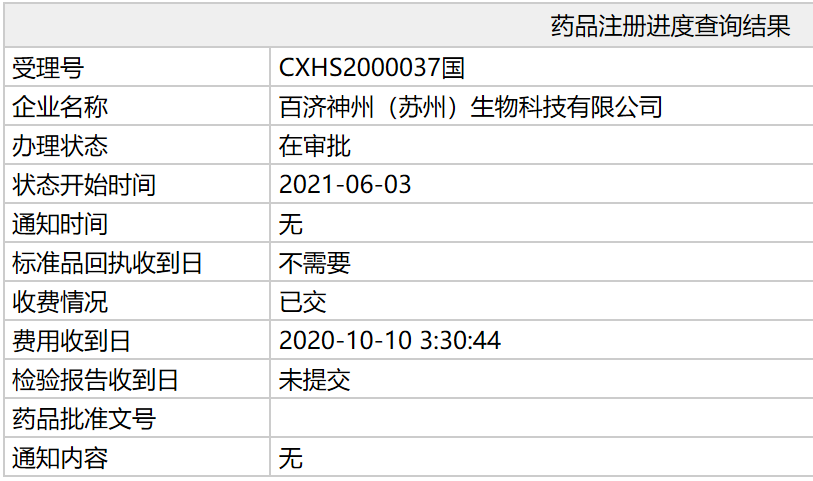
中国国家药品监督管理局(NMPA)官网显示,百济神州的BTK抑制剂泽布替尼(zanubrutinib)一项新适应症上市申请已更新为:在审批,意味着该产品有望在中国迎来新适应症。公开资料显示,此次泽布替尼有望获批的新适应症为:治疗成人华氏巨球蛋白血症(WM)患者。
泽布替尼是一款小分子BTK抑制剂,于2019年11月获得美国FDA批准,成为首款在美国获批的中国本土原研抗癌药。2020年6月,泽布替尼又在中国获批两项适应症,涵盖套细胞淋巴瘤(MCL)和慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。
公开资料显示,这款新药在
设计上通过优化生物利用度、半衰期和选择性,可实现对BTK蛋白完全、持续的抑制。
凭借差异化的药代动力学,泽布替尼能在多个疾病
相关组织中抑制恶性B细胞增殖。
目前,该产品
正在全球进行广泛的临床试验项目,作为单药和与其他疗法进行联合用药治疗多种B细胞恶性肿瘤
。
此次泽布替尼进入“在审批”的新适应症上市申请,于2020年9月获得NMPA药品审评中心(CDE)受理,随后被CDE纳入优先审评,用于治疗成人华氏巨球蛋白血症患者。华氏巨球蛋白血症是一种相对罕见的B细胞淋巴瘤,在非霍奇金淋巴瘤患者中占比不到2%。该疾病通常出现在年长患者中,对于这类患者而言,如何选择缓解率良好、同时安全性和耐受性较高的治疗方案,是临床上亟待解决的一大难题。

公开资料显示,这一申请主要是基于一项泽布替尼在中国开展的、治疗复发或难治性华氏巨球蛋白血症的关键性2期临床试验(BGB-3111-210研究)结果。根据百济神州在2020年12月发布的新闻稿数据显示,
中位随访时间为18.58个月时,定义为
部分缓解或更佳的主要缓解率(MRR)为69.8%
,其中非常好的部分缓解(VGPR)率为32.6%,部分缓解(PR)率为37.2%;
定义为
轻微缓解或更佳的客观缓解率(ORR)为79.1%
;
达到VGPR和总缓解的中位时间分别为2.87个月和2.76个月;
中位无进展生存期(PFS)和主要持续缓解时间(DOMR)尚未到达。
在安全性方面,最常见的任一级别治疗期间出现的不良事件(TEAE)有中性粒细胞计数减少、血小板计数减少、白细胞计数减少、上呼吸道感染等。72.7%的患者经历了至少一起3级及以上的TEAE,50.0%的患者经历了至少一起严重TEAE,11.4%的患者由于TEAE中断试验治疗。
BGB-3111-210研究的主要研究者、中国医学科学院血液病医院淋巴瘤诊疗中心主任邱录贵教授曾表示,该研究结果令人欣慰,主要缓解率将近70%,而达到主要缓解的中位起效时间也在三个月之内,证明泽布替尼能在华氏巨球蛋白血症患者中快速地产生深度且持久的缓解,尽管这些患者中大多数人根据预后评分系统属于中危或高危。泽布替尼的安全性数据也与先前在华氏巨球蛋白血症患者中所观察到的数据相符。
2019年11月,在美国获批用于治疗既往接受过至少一项疗法的MCL患者;
2020年6月,在中国获批用于治疗既往至少接受过一种治疗的成年MCL患者;
2020年6月,在中国获批用于治疗既往至少接受过一种治疗的成年CLL/SLL患者;
2021年2月,在阿拉伯联合酋长国获批用于治疗复发或难治性MCL患者;
2021年3月,在加拿大获批用于治疗华氏巨球蛋白血症成年患者。
目前,除美国和中国以外,共有30多项泽布替尼针对多项适应症的相关上市申请完成递交工作,覆盖欧盟以及其他20多个国家和地区。
希望百济神州泽布替尼早日在中国获批华氏巨球蛋白血症的新适应症,为更多患者提供新的治疗选择。
注:
本文旨在介绍医药健康研究进展,不是治疗方案推荐。
如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局注册进度查询. Retrieved Jun 11,2021 from http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?tableId=43&tableName=TABLE43&columnName=COLUMN464,COLUMN475&title=%D2%A9%C6%B7%D7%A2%B2%E1%BD%F8%B6%C8%B2%E9%D1%AF
[2]百济神州在第62届美国血液学会(ASH)年会上公布百悦泽®(泽布替尼)用于治疗B细胞恶性肿瘤和华氏巨球蛋白血症的临床试验数据. Retreved Dec 8, 2020 from https://mp.weixin.qq.com/s/oRoI18T1X5TrKO2lf0J1Qw
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。








 个人中心
个人中心
 我是园区
我是园区




