
▎Armstrong
FDA今年共批准8款抗体新药,累计批准抗体新药达到107款。

2021年FDA批准的8款抗体新药中,4款为抗肿瘤药物,2款为自免药物,1款为阿尔茨海默症药物,1款为降血脂药物。从药物形式上看,包含5款单抗、2款ADC和1款双抗。

Evkeeza:ANGPTL3抗体,FIC
Evkeeza为FDA今年批准的第1款抗体新药,也是FDA批准的第100款抗体新药,为靶向ANGPTL3的降血脂FIC新药,由再生元研发。

Jemperli:PD-1抗体
Dostarlimab为FDA批准的第4款PD-1抗体,最初由Anaptysbio研发,为首个动物细胞展示平台技术来源的抗体药物。药明生物为Dostarlimab提供CMO服务。

Zynlonta:CD19 ADC
Zynlonta为首个CD19 ADC新药,由ADC Therapeutics研发,采用PBD毒素和SG3249连接子。2020年12月14日,高瓴资本旗下瓴路药业宣布与ADC Therapeutics组建合资公司,出资5000万美元引进后者的四款ADC药物(loncastuximab tesirine、ADCT-601、ADCT-602 和 ADCT- 901),占合资公司51%股份。


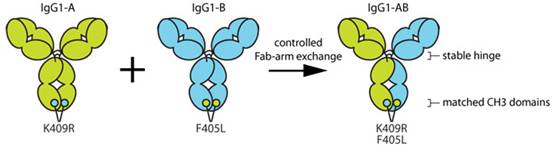
Rybrevant:EGFR/cMET双抗,FIC
Rybrevant为FDA批准第3款双抗,用于治疗EGFR20外显子插入突变的NSCLC。

Rebrevant采用Genmab的Duobody技术构建,在两条重链的CH3分别引入K409R和F405L突变,体外通过Fab exchange形成双特异性抗体。
Aduhelm:Aβ单抗,FIC
Aduhelm为Aβ单抗,是FDA2003年以来批准的首个阿尔茨海默症药物。但由于临床疗效存在巨大争议,FDA专家委员会建议拒绝批准。虽然FDA选择批准Aduhelm上市,但受到医生的普遍抵制,2021年前三季度销售额仅200万美元,其中三季度销售额仅30万美元。Aduhelm刚刚遭到EMA拒绝批准,Biogen正计划开展上市后的验证性临床试验,预计需要五年时间。

Aduhelm是一款筛选自健康老年人的全人源抗体,临床ADA发生率为0.6%。国内仅恒瑞医药申报Aβ单抗,研发代码为SHR-1707。
Saphnelo:IFNAR1抗体,FIC
Anifrolumab为贝利木单抗之后10年来第一款狼疮新药,其开发之路颇为坎坷,2018年首个三期临床TULIP 1以失败告终,该研究的评估终点为SRI4。2019年,Anifrolumab的第2项三期临床宣告成功,该研究以BICLA为评估终点。

国内方面,智翔金泰和荃信生物的IFNAR1抗体已经申报临床。
Tivdak:TF ADC,FIC
Tisotumab Vedotin为靶向组织因子(TF)的FIC药物,二期临床表现出优异的疗效。

国内方面,乐普生物研发了国内首个TF ADC,今年2月获得FDA批准临床,今年6月在国内递交临床试验申请。与tisotumab vedotin采用的通过链间硫醇基团的传统偶联技术不同,MRG004A是乐普生物/美雅珂基于从Synaffix引进的GlycoConnect定点偶联技术和HydraSpace极性间隔技术开发的一款创新ADC药物。

Tezspire:TSLP抗体,FIC
Tezspire的研发也颇为曲折,2020年11月10日,阿斯利康宣布TSLP抗体Tezepelumab的三期临床NAVIGATOR获得成功。2020年12月22日,阿斯利康宣布Tezepelumab的第二项三期临床SOURCE失败。这两项三期临床的主要终点标准不同,SOURCE的主要终点为口服激素减少的剂量。NAVIGATOR的主要终点为AAER的下降。虽然不能减少激素用量,但Tezepelumab降低AAER的效果还是非常显著的,因此顺利获得FDA批准上市。

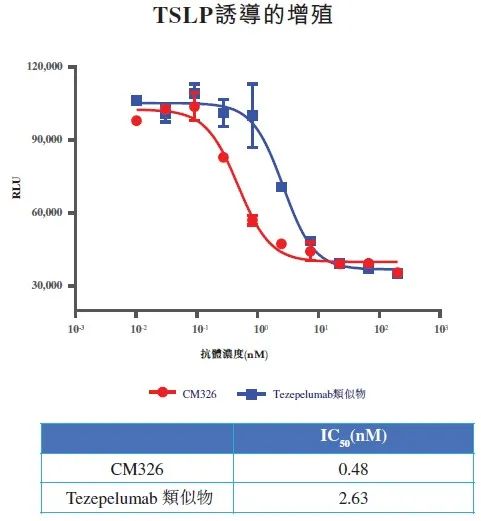
国内已经有4款TSLP抗体申报临床,分别来自康诺亚、博奥信/正大天晴、恒瑞医药、和铂医药/科伦博泰,其中康诺亚CM326为国内首家,体外细胞学研究表明CM326的生物活性约为Tezepelumab的6倍,有望转化为更好的临床疗效。
Vyvgart:Fc突变体,FIC
Vyvgart并非完整抗体,而是Fc突变体,靶向FcRn,用于治疗自身免疫性疾病。Efgartigimod由Argenx研发,在IgG1 Fc引入了5个位点突变:M252Y、S254T、T256E、H433K、N434F。Efgartigimod在酸性和碱性条件下与FcRn的亲和力均增强,pH=6.0的亲和力为14.2nM,pH=7.4的亲和力为320nM。


2021年1月7日,再鼎医药宣布与Argenx达成合作,再鼎医药以7500万美元预付款+1亿美元里程碑金额,获得Argenx的Efgartigimod的大中华区权益。其中,7500万美元以股权形式支付,发行给Argenx以568182股再鼎医药的股份。
总结
2021年FDA批准的抗体新药数量并非最多,但凸显了抗体药物研发的深化,新型抗体药物形式越来越多,双抗、ADC、Fc突变体不一而足。抗体药物的筛选技术也越来越多样化,除了传统的人源化、转基因动物,人B细胞测序(Aducanumab)、动物细胞展示等技术来源的抗体也进入商业化阶段。新靶点抗体药越来越多,除了PD-1抗体Dostarlimab外,其他抗体新药几乎全都是FIC。公众号回复“说明书”,可下载其说明书。

版权声明/免责声明
本文为授权转载文章,仅代表作者观点,版权归作者。
仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
欢迎朋友们批评指正!衷心感谢!
文中图片、视频为授权正版作品,或来自微信公共图片库,或取自网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系(电话:13651980212。微信:27674131。邮箱:contact@drugtimes.cn)。衷心感谢!

推荐阅读
 点击这里,与~20万同药们喜相逢!
点击这里,与~20万同药们喜相逢!



 个人中心
个人中心
 我是园区
我是园区




