 昨日(2022年1月18日),优时比公布了其IL-17 A/F Bimzelx( Bimekizumab)在治疗放射学阴性中轴脊柱关节炎(nr-axSpA)的Ⅲ期临床试验BE MOBILE 2在所有终点上均显示出统计学意义,达到了试验
主要终点和所有关键次要终点
。公司计划今年第三季度提交该适应症的上市申请。
昨日(2022年1月18日),优时比公布了其IL-17 A/F Bimzelx( Bimekizumab)在治疗放射学阴性中轴脊柱关节炎(nr-axSpA)的Ⅲ期临床试验BE MOBILE 2在所有终点上均显示出统计学意义,达到了试验
主要终点和所有关键次要终点
。公司计划今年第三季度提交该适应症的上市申请。

Bimekizumab是一款同时选择性地抑制IL-17A与IL-17F的人源IgG1单克隆抗体。IL-17A和IL-17F具有重叠的促炎功能,并且分别与其它炎症介质形成协同作用,驱动慢性炎症和跨多个组织的损伤。此前的临床前研究显示,与IL-17A单独阻断相比,IL-17A和IL-17F的双重中和导致炎症相关基因和细胞因子表达水平降低,对疾病相关免疫细胞迁移的抑制更大。
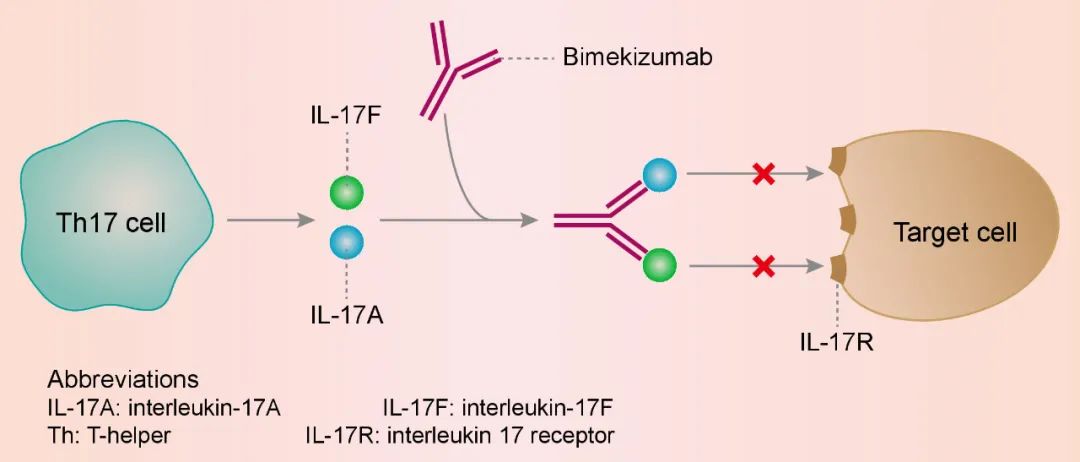
在治疗中重度斑块型银屑病,bimekizumab疗效已被证实优于阿达木单抗,喜达诺以及可善挺。去年8月,Bimzelx在欧盟获批。此外,bimekizumab在美国,日本、澳大利亚、加拿大的监管审查也正在进行中。
放射学阴性中轴脊柱关节炎是bimekizumab目前临床开发进度次于斑块型银屑病的第二大适应症。此次公布的最新临床试验结果显示,在治疗第16周时,与安慰剂组相比,bimekizumab治疗组有更高比例患者达到ASAS40应答(国际脊柱关节炎评估协会评分改善至少40%)。此外,所有重要的次要终点,包括在第16周时,bimekizumab治疗组与安慰剂组相比,在患者报告疾病活动度(采用Bath强直性脊柱炎疾病活动指数(BASDAI)测量)、达到ASAS部分缓解以及强直性脊柱炎疾病活动评分(ASDAS)重大改善、夜间脊柱疼痛评分显著改善。试验中的安全性与既往研究一致,未观察到新的安全性信号。

参考出处
https://www.ucb.com/stories-media/Press-Releases/article/Positive-Top-Line-Results-for-BimzelxRVbimekizumab-in-Phase-3-Non-Radiographic-Axial-Spondyloarthritis-Study




 个人中心
个人中心
 我是园区
我是园区




