▎药明康德内容团队报道
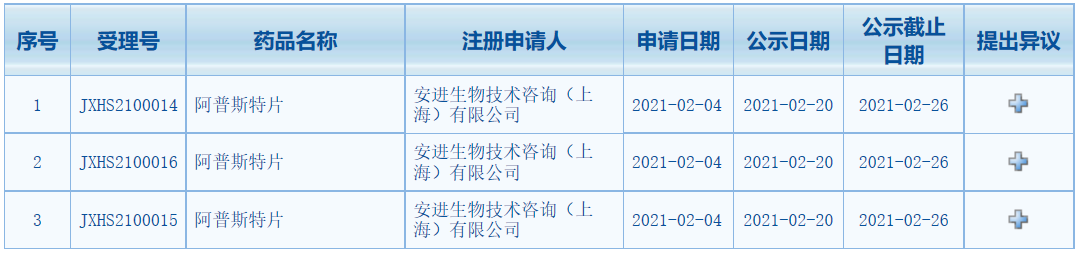
中国国家药品监督管理局药品审评中心(CDE)最新公示,安进(Amgen)阿普斯特片(apremilast)3项新药上市申请拟纳入优先审评,拟定适应症为银屑病。该产品最初由百时美施贵宝(BMS)旗下新基(Celgene)公司研发,安进于2019 年8月宣布以高达134亿美元收购获得了阿普斯特全球权益。在中国,阿普斯特已被纳入第一批临床急需境外新药名单。

阿普斯特是一种新型的口服小分子磷酸二酯酶4(PDE4)抑制剂
,通过剂量依赖性抑制人类滑膜细胞释放肿瘤坏死因子(TNF)-α而发挥作用。目前,阿普斯特已在美国获批的适应症有:1)适合光疗或全身治疗的中度至重度斑块型银屑病患者;2)患有活动性银屑病关节炎的成年患者;3)患有与白塞病相关口腔溃疡的成年患者。
2月3日,安进和新基在中国共同提交了三项阿普斯特片新药上市申请并获得CDE受理。根据CDE公示,此次该三项上市申请拟纳入优先审评,对应规格分别为10mg、20mg、30mg,拟定适应症均为银屑病。
值得一提的是,银屑病也是阿普斯特在中国纳入临床急需境外新药的适应症。这是一种慢性、复发性、免疫介导多系统疾患。中至重度银屑病可降低降低生活质量甚至致残,传统药物(甲氨蝶呤(MTX)、阿维A、环孢素及其他药物)有效性有限且存在多种潜在毒性。阿普斯特已在中国境外研究中被证明具有治疗效果并且耐受性良好,为口服途径给药,具有全新的作用靶点。
在一项名为ADVANCE的多中心、随机、含安慰剂对照组的3期临床研究中,阿普斯特治疗轻中度斑块状银屑病患者达到了该试验的主要终点。与安慰剂组相比,在第16周的静态医生总体评估(sPGA)中,候选药使患者的皮肤状况达到了统计学意义上的显著改善。另一项名为ESTEEM 1的研究结果显示,与安慰剂相比,接受阿普斯特预防治疗的患者银屑病面积和严重程度指数改善75%(PASI-75)的患者,在16周时明显多于安慰剂(33.1% vs 5.3%)。
此次阿普斯特在中国拟纳入优先审评,意味着这款产品有望在中国加速获批,希望该产品早日惠及更多中国患者。
牛年开启,为了更全面地了解《医药观澜》微信号的读者群,从而为您提供更有针对性的内容,我们特邀请您在百忙之中扫描下方二维码或点击文末“阅读原文”填写一份调查问卷。此次问卷为不记名问卷调查,问卷内容不涉及任何个人信息等敏感信息,调查结果不对外公开,仅用于内部评估,并作为本年度内容推送的重要参考依据。谢谢您的配合与支持,我们将用心倾听您的声音。

版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]中国国家药监局药品审评中心. Retrieved Feb 3,2021, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#
[2] MAmgen To Acquire Otezla® For $13.4 Billion In Cash, Or Approximately $11.2 Billion Net Of Anticipated Future Cash Tax Benefits. received Aug, 26th from http://investors.amgen.com/news-releases/news-release-details/amgen-acquire-otezlar-134-billion-cash-or-approximately-112
[3] Amgen Announces Positive Top-Line Results From Otezla® (apremilast) Phase 3 ADVANCE Study In Mild-To-Moderate Plaque Psoriasis. Retrieved 2020-05-06, from https://www.prnewswire.com/news-releases/amgen-announces-positive-top-line-results-from-otezla-apremilast-phase-3-advance-study-in-mild-to-moderate-plaque-psoriasis-301053621.html
[4]程刚英, 杨洋, 刘珏. 阿普斯特用于治疗银屑病关节炎的疗效和安全性的Meta分析[J]. 中国医院药学杂志, 2017, 037(020):2065-2071.








 个人中心
个人中心
 我是园区
我是园区




