「 本文共:16条资讯,阅读时长约:3分钟 」


华津溶瘤细菌获FDA肝癌孤儿药资格。华津医药拥有完整知识产权和全球权益的溶瘤产品SGN1(桑美威克®,SalMet-Vec®)获FDA授予孤儿药资格认定(ODD),用于治疗肝细胞癌(HCC)。SGN1通过减毒沙门氏菌载体搭载特异的甲硫氨酸水解酶,剥夺肿瘤生长所需的必须氨基酸,从而杀伤肿瘤并阻止肿瘤扩散。此前,SGN1已获得FDA授予用于治疗骨肉瘤的孤儿药资格。


1.上海葆正引进妇科新药上Ⅲ期临床。葆正医药与Kissei公司开发的GnRH拮抗剂BG2109(linzagolix)在中国用于绝经前女性子宫肌瘤相关月经出血过多的Ⅲ期临床首例受试者入组。Linzagolix旨在通过结合和阻断脑垂体中的GnRH受体,减少卵巢的雌激素生成。2022年6月,linzagolix片(商品名Yselty)已在欧盟及英国获批上市,单用或联合雌孕激素反向添加治疗(ABT),用于治疗育龄妇女子宫肌瘤中重度症状。
2.安科CD7靶向CAR-T获欧盟孤儿药资格。安科生物旗下博生吉医药靶向CD7的嵌合抗原受体(CAR)-T细胞注射液PA3-17获欧盟委员会(EC)授予的孤儿药资格,用于治疗复发/难治的T细胞急性淋巴细胞白血病/淋巴瘤。PA3-17已在前期试验中取得积极结果,客观缓解率(ORR)高达95%,完全缓解率接近80%。此前,该新药已获得FDA授予的孤儿药资格,并在中国获批临床。
3.经久生物泛FGFR抑制剂国内获批临床。经久生物新一代FGFR抑制剂KIN-3248获国家药监局临床试验默示许可。这是一项国际I期临床,今年1月已获得FDA临床许可,旨在评估KIN-3248在携带FGFR2/3基因改变晚期实体瘤中的疗效和安全性。临床前研究显示,KIN-3248对携带原发性FGFR2/3基因改变的肿瘤,以及携带FGFR2/3继发性耐药突变的肿瘤均具有显著的抗肿瘤活性效果,有望为患者提供新的治疗选择。
4.道尔生物Claudin18.2抗体拟开展胃癌临床。道尔生物Claudin18.2抗体DR30303拟联合默沙东PD-1抑制剂KEYTRUDA®(帕博利珠单抗),开展联合治疗Claudin 18.2阳性、局部晚期不可切除或转移性胃癌或胃食管连接部癌(GC/GEJ)患者的临床试验。临床前研究显示,DR30303在多种小鼠肿瘤模型中单独用药,或与化疗药物或PD-1抑制剂联合使用,均显示出积极的抗肿瘤活性。
5.天演与罗氏达成临床试验合作。天演药业CTLA-4安全抗体SAFEbody ADG126拟联合罗氏PD-L1阿替利珠单抗和VEGF单抗贝伐珠单抗,开展用于一线治疗晚期肝细胞癌(HCC)的国际Ⅰb/Ⅱ期临床试验。天演药业的安全抗体SAFEbody技术可最大限度地减轻由于靶向在健康组织中表达的靶点而诱发的毒副作用,从而解决众多抗体疗法面临的安全性与耐受性挑战。本次合作将由罗氏资助。


1.FDA批准首款膀胱癌基因疗法上市。Ferring公司基因疗法Adstiladrin(nadofaragene firadenovec)获FDA批准上市,成为首款基因疗法,用于治疗对卡介苗(BCG)无应答的高风险非肌层浸润性膀胱癌(NMIBC)患者。Adstiladrin旨在将编码干扰素α-2b的转基因递送至膀胱,以制造大量的干扰素,增强机体抵抗癌症。在临床试验中,BCG无应的NMIBC患者每3个月接受一次Adstiladrin的治疗,完全缓解率达到51%,中位缓解持续时间为9.7个月。
2.CLDN18.2抗体两项胃癌Ⅲ期临床成功。安斯泰来宣布CLDN18.2单抗zolbetuximab联合CAPOX(包括卡培他滨和奥沙利铂的联合化疗方案),以及zolbetuximab联合mFOLFOX6(包括奥沙利铂、亮菌甲素和氟尿嘧啶的联合方案),分别在治疗Claudin 18.2阳性、HER2阴性的局部晚期不可切除或转移性胃癌和胃食管结节(GEJ)癌(GLOW研究)和胃或胃食管连接处(GEJ)腺癌(SPOTLIGHT研究)的两项Ⅲ期临床均达到主要终点和关键次要终点。两种联合治疗方案均显著提高无进展生存期和总生存期。详细结果将公布在科学大会上。
3.FIC口服IRAK4蛋白降解剂将启动Ⅱ期临床。Kymera公司与赛诺菲联合开发的潜在FIC口服IRAK4蛋白降解剂KT-474,在治疗化脓性汗腺炎(HS)和特应性皮炎(AD)患者的Ⅰ期临床中获积极结果。KT-474在给药4周后,显著降低患者IRAK4水平(最大降解超过90%),并广泛抑制针对多种疾病相关的促炎细胞因子和趋化因子;大多数HS和AD患者表现出实质性的缓解。KT-474总体耐受性良好。两家公司计划明年启动KT-474的Ⅱ期临床。
4.首款庞贝病口服GYS1抑制剂早期临床积极。Maze公司拟用于治疗庞贝病的口服糖原合成酶1(GYS1)抑制剂MZE001,在健康受试者中开展的Ⅰ期临床获积极结果。MZE001旨在抑制庞贝病的致病原因——糖原累积。数据显示,MZE001能降低生物标志物血细胞糖原水平,单剂与多剂量递送时具有良好的耐受性,并显示出一天两剂的药代动力学特征。详细数据将公布于明年WORLD会议当中。
5.SCFR/c-Kit抑制剂因肝毒性问题终止开发。Third Harmonic Bio公司宣布终止SCFR/c-Kit抑制剂THB001治疗慢性诱导性荨麻疹成年患者的Ib期研究。在剂量一队列(200mg,每日2次)5例患者中,观察到2例患者在接受治疗后出现无症状的肝转氨酶炎。目前已入组的所有患者均已停药,并不再招募患者,但随访将按照方案继续进行。初步结果显示,200mg BID的THB001具备药效学和临床活性。
6.礼来布局GPCR小分子药物。礼来与Sosei Group Corporation达成合作许可协议,将利用后者StaR技术平台和基于结构的药物设计(SBDD)平台,为礼来提名的多个GPCR靶标合作开发新型G蛋白偶联受体(GPCR)小分子候选药物,用于糖尿病和代谢疾病相关的治疗。根据协议,Sosei将获得3700万美元的预付款,最高6.94亿美元的开发和商业里程碑潜在付款,以及全球销售的分级特许权使用费。


1.苏州核酸亭变“发热诊疗站”。近日,江苏苏州姑苏区社区卫生服务机构陆续新增31个发热诊室和发热诊疗站。“发热诊疗站”由核酸采样点改造而成,设置为“一医一护” 服务模式,为社区发热患者提供一站式就医服务。从诊疗、开具处方、配药和到完成医保结算、pos机刷卡,整个过程约10分钟即刻完成。
2.山西:开展线上义诊咨询。12月14日起,山西省卫健委、山西省医学会联合开展线上义诊咨询服务,组织各学科专家积极投身到活动中,为广大居民提供线上健康咨询服务。有咳嗽、发热等症状的患者,或有其他健康咨询需求的居民,可通过“健康山西微服务”微信公众号或“健康山西”App咨询。
3.三级医院评审标准“更新式”修订。国家卫健委日前印发《三级医院评审标准(2022年版)》及其实施细则,在2020年版《标准》基础上进行三方面“更新式”修订,旨在保障医院评审标准与现行政策的一致性,充分发挥医院评审工作在推动医院加强内涵建设、完善和落实医院管理制度、提高管理水平和保障医疗质量安全中的作用。
4.葛均波院士加盟上海理工大学新学院。12月16日,上海理工大学举行东方泛血管器械创新学院成立大会,海军军医大学第一附属医院脑血管病中心主任刘建民受聘为学院荣誉院长,中国科学院院士、复旦大学附属中山医院心内科主任葛均波受聘为学院院务委员会主任、首席科学家。上海理工大学成立东方泛血管器械创新学院,旨在坚持需求导向、问题导向、效果导向,着力培育泛血管领域的高质量医工交叉项目,形成研究生教育改革“特区”,构建“面向人民生命健康”的医工交叉创新新格局。


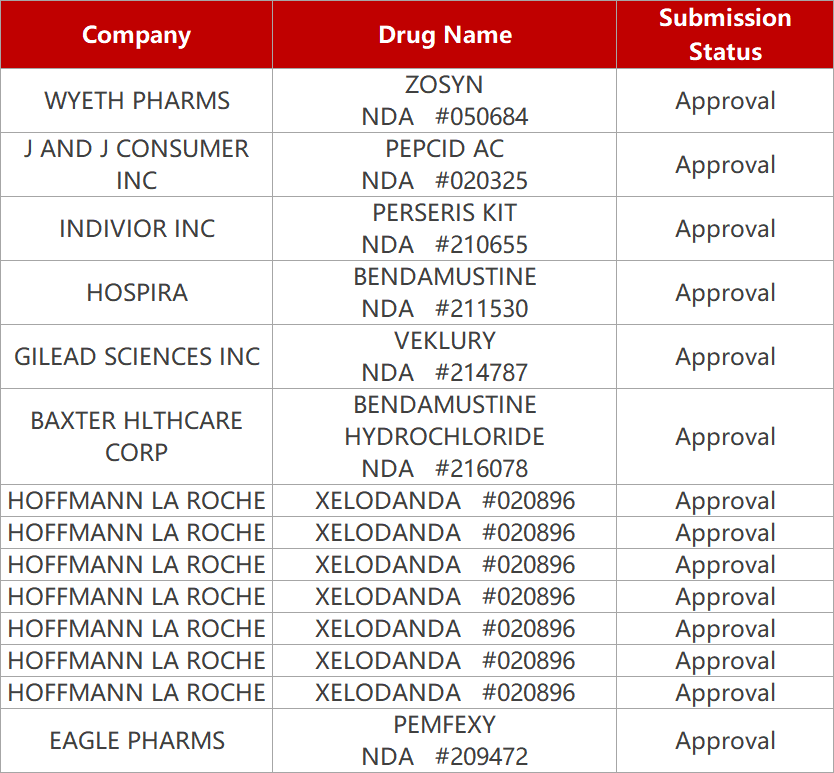
1. CDE新药受理情况(12月17日)



上个交易日 A 股医药板块 +1.33%
【健友股份】普乐沙福注射液获得美国FDA暂时批准。
【天士力】芪参益气滴丸新增适应症获得药物临床试验批准通知书。
【沃森生物】新型冠状病毒变异株mRNA疫苗(S蛋白嵌合体)获得II期临床试验伦理审查。批件。
- The End -





 个人中心
个人中心
 我是园区
我是园区




