
基于NextPharma全球新药数据库,医药魔方每月定期为大家盘点全球医药交易概况以及新药研发与注册进展重要事件(中英双语版本),报告现已上线医药魔方NextPharma数据库,魔方客户可直接登录账户进入“研究报告”模块下载浏览。非魔方客户如需订阅全球医药交易交易&研发进展双月刊,可扫下方二维码申请:

【1月全球医药交易概况】

2022年1月全球项目交易共发生103笔,其中涉及国内交易26笔,国外交易77笔;基于每年1月份JPM会议的召开,国外交易较为活跃,整体交易趋势基本与往年1月份近似。另外,今年1月份的全球公司并购交易不多,较为值得注意的一笔公司收购是:1月19日,UCB收购Zogenix,扩大治疗癫痫和罕见病药物管线。
从交易金额上看,1月份全球项目交易首付款15.35亿美元,交易总金额255.52亿美元;其中国内项目交易首付款为0.5亿美元,国内/全球(首付款)占比3.3%,交易总金额为10.62亿美元,国内/全球(总金额)占比4.2%。
-- 1月份的国内项目交易26笔,海外license in数量有8笔,国内企业之间项目交易有13笔,其中license out交易有5笔:分别是奕拓医药和罗氏达成研发合作;和誉医药与礼来开展全球合作,发现与开发新型小分子药物;君实生物TIGIT单抗的“出海”;信达生物/驯鹿医疗的BCMA细胞疗法药物的海外授权;三生国健的PD1单抗的海外授权等。此外本月需要关注的交易有:曙方医药、典晶生物布局罕见病药物的license in等。
-- 1月份海外交易共计77笔,其中涉及技术或早期药品研发的交易共计55笔,其余交易项目以创新药为主;比较值得关注的是MNC的大额交易事件,其中Pfizer的交易愈加频繁,在1月中旬的2天宣布了4项交易,布局AI制药、双抗、体内基因编辑等前沿技术;Amgen、赛诺菲、阿斯利康、MSD等相继布局AI制药;另外,像RNAi疗法、基因编辑技术、双抗等新型疗法的交易愈加火热。
1月海外交易受让方数量统计中,Pfizer以6笔交易排名第一

信息来源:医药魔方NextPharma全球新药数据库
下文精选国内外部分重要交易,概览如下:更多交易详情请关注NextPharma数据库交易模块与最新上线的每月交易月报。
国内交易

1. 超1亿美元!艾迈医疗宣布与韩美制药达成许可协议,在大中华区推进开发和商业化 Risuteganib (Luminate®)

1月4日,艾迈医疗子公司蔼睦医疗宣布与韩美制药达成许可协议,蔼睦医疗获得针对治疗中期干性年龄相关性黄斑变性及其他玻璃体视网膜疾病,同类首创玻璃体内注射产品 Risuteganib/Luminate®在大中华区(包括中国大陆、香港、台湾和澳门)的独家生产、开发和商业化权利。
根据协议条款,韩美将可获得总计 1.45 亿美元,其中包括 600 万美元预付许可费,以及相关开发、注册和销售的里程碑付款。韩美还将能够从 Risuteganib的净销售额中按比例获得销售分成。
Luminate® 是 Integrin 调节剂同类产品中的首创新药,其具备全新的作用机制,能够调节包括线粒体功能障碍在内氧化应激反应的多个通路,而线粒体功能障碍会引发中期干性 AMD 等疾病。
相关信息:
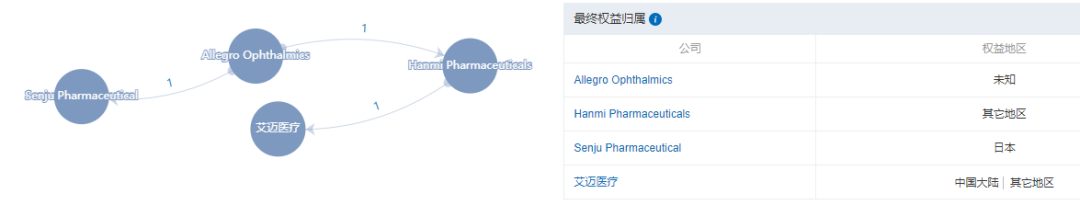
1)2015年1月,韩美制药从 Allegro Ophthalmic LLC 获得了 Risuteganib (Luminate®) 在韩国和中国进行玻璃体内用药的独家开发和商业化权利。
Risuteganib权益详情:
来源:医药魔方NextPharma®
2)Risuteganib在一项Ⅱ期POC试验中成功达到主要终点,与安慰剂相比,用药的中期干性 AMD 患者的视力改善表现出统计学意义。Allegro 已与FDA达成特别方案评估 /SPA协议,以推进 Risuteganib (Luminate®) 进入Ⅱb/Ⅲ期关键临床试验注册计划。
3)Integrin是细胞粘附和信号蛋白,在各种广泛的生物学功能中起着非常重要的作用。目前,靶向整合素的药物已经在包括肿瘤领域、心脑血管疾病、炎症性肠病/多发性硬化症和干眼病等领域得到广泛开发,目前国内尚无自主研发相关药物获批上市。
国内Integrin药物竞争格局:

来源:医药魔方NextPharma®

1月11日,君实生物称Coherus已启动行使TIGIT单抗JS006在美国和加拿大的许可选择权的程序。同时,Coherus将向君实生物支付3500万美元首付款,最高达2.55亿美元的开发、申报和销售里程碑付款,以及产品销售净额18%的销售分成。
早在2021年2月,君实生物与Coherus已就PD-1单抗特瑞普利单抗注射液达成合作。根据协议条款,君实生物授予Coherus特瑞普利单抗在美国和加拿大开发和商业化的许可,JS006(TIGIT单抗)和JS018-1(新一代改良IL-2细胞因子药物)的选择权,以及2个早期阶段检查点抑制剂抗体药物的优先谈判权,交易总额高达11.1亿美元。
2021年,君实生物启动一项I期研究,旨在评估JS006单药及联合特瑞普利单抗治疗标准治疗失败或没有标准治疗的晚期肿瘤患者的安全性和耐受性。君实生物与Coherus计划在北美开展JS006与特瑞普利单抗联合治疗的后期临床试验。
相关信息:
1)值得一提的是,去年12月20日,百济神州宣布与诺华扩大合作,双方将在北美、欧洲和日本共同开发、生产和商业化百济神州在研TIGIT单抗ociperlimab,交易总额高达27.95-28.95亿美元,刷新了中国本土创新药单品种海外授权交易的最高纪录。
国外交易

1、50亿美元!Exscientia与赛诺菲建立战略研究合作,开发AI驱动的精准工程药物产品线

1月7日,赛诺菲和Exscientia宣布了一项新合作,双方将借助Exscientia利用实际病人样本的端到端人工智能驱动平台,开发多达15种涉及肿瘤学和免疫学的新型小分子候选药物。自2016年起,两家公司便开始持续合作。2019年,赛诺菲授权Exscientia开发了新型双特异性小分子候选药物,能够靶向作用于炎症和免疫相关的两个不同靶点。
Exscientia和赛诺菲将利用Exscientia的个性化医疗平台,共同确定和筛选目标项目,该平台可将原始人体组织样本整合至早期的靶点和药物开发研究,从而实现了“患者优先”原则。除了靶点筛选,Exscientia还负责小分子药物设计和先导优化工作,而赛诺菲将负责候选药物临床前和临床阶段的开发、生产和商业化。
根据协议条款,Exscientia公司将获得赛诺菲公司1亿美元的预付现金,如果所有项目的全部里程碑都能实现,Exscientia则有资格获得涉及未来研究、转化、临床开发、监管和商业里程碑付款,总金额高达约52亿美元;以及从高个位数到中双位数不等的产品销售提成,最高可至21%。
相关信息:
1)Exscientia是一家由人工智能驱动的制药公司,致力于以迅速而有效的方式发现、设计和开发尽可能优质的药物。目前已有超过25个项目正在推进,包括首批进入1期临床试验的三种人工智能设计的候选药物。
1月份国外AI交易:

来源:医药魔方NextPharma®

1月10日,辉瑞与Beam Therapeutics达成合作协议,共同开发最多3款体内基因编辑疗法,专注于肝脏、肌肉和中枢神经系统等罕见基因疾病(目前,这些疗法都不在Beam现有管线内)。根据该协议,Beam将获得3亿美元的预付款,未来还有资格获得高达10.5亿美元的里程碑付款,潜在的合作项目总代价高达13.5亿美元。另外,Beam可选择为合作中的任一项目签订全球共同开发和共同商业化协议,从项目的全球净销售额中获得35%的版税。合作的初始期限为四年,并可延长至一年。
一月份Pfzier交易清单

来源:医药魔方NextPharma®
相关信息:
1)Beam Therapeutics为CRISPR领域头部公司,创始人为刘如谦、张锋等。Beam Therapeutics开发了单碱基编辑、核酸递送等多个技术平台,在这些技术平台的基础上,Beam可以进行基因矫正、基因修饰、基因激活、基因静默等多种编辑方式。此外,Beam已经建立起丰富的研发管线,包括多种基于LNP递送系统的肝靶向体内基因编辑疗法。
Beam公司管线:

来源:Beam Therapeutics官网


2022年1月4日,AbbVie宣布FDA授予telisotuzumab vedotin用于正在接受或接受过含铂疗法后疾病进展的c-Met高表达患者,治疗晚期/转移性EGFR野生型非鳞非小细胞肺癌的突破性疗法资格。此资格授予基于2期试验LUMINOSITY(NCT03539536)试验数据,该项正在进行的 2 期临床研究,旨在确定在二线或三线高表达 c-Met 的目标 NSCLC 人群中Teliso-V 单药的治疗效果,试验主要终点是随访≥12周患者的总缓解率(ORR)。先前报道的中期分析表明,EGFR WT 非鳞状 NSCLC 患者中,c-Met 高表达组的 ORR 达到 53.8%。Telisotuzumab vedotin是一种靶向c-Met的ADC药物,正在联合奥希替尼开展针对初治c-Met过表达NSCLC的1期试验M14-237(NCT02099058)。
相关信息:
1、c-Met抑制剂通常只对c-Met激活信号驱动的肿瘤有效,抗体偶联药物如ABBV-399具有不同的机制,可将强力细胞毒药物递送到c-Met过度表达的肿瘤细胞,不论这些肿瘤细胞是否依赖c-Met信号
2、目前全球C-Met ADC管线共有8个,国内恒瑞、荣昌等企业均有布局,其中恒瑞的SHR-A1403为重大专项品种。

信息来源:医药魔方NextPharma数据库

2022年1月26日,Immunocore宣布FDA批准Kimmtrak(tebentafusp)一线治疗HLA-A*02:01阳性不可切除或转移性葡萄膜黑色素瘤。这是FDA批准的首个也是唯一一个治疗此适应症疗法,也是首个获批的TCR疗法。此批准基于3期试验IMCgp100-202(NCT03070392)结果,该研究旨在评估tebentafusp对既往未经治疗的转移性葡萄膜黑色素瘤患者的疗效,是在转移性葡萄膜黑色素瘤患者患者中开展的最大规模III期研究。该研究结果曾在2021年9月发表于《新英格兰医学杂志》 。数据显示,与研究者选择的其他疗法(82%帕博利珠单抗;12%伊匹木单抗;6% 达卡巴嗪)相比,tebentafusp单药在总生存期(OS)方面具有显著临床和统计学意义优势,将死亡风险降低了49%(HR:0.51;95% CI:0.37-0.71;p< 0.0001) 。安全性方面,治疗相关的不良反应是可控的,并且与药物预期的机制一致。tebentafusp组最常见3级或以上不良反应为皮疹(18%)、发热(4%)和瘙痒(5%),3级细胞因子释放综合征(CRS)发生率<1%,且总体管理良好。未观察到4级或致命的CRS事件。不过Kimmtrak的药品标签带有黑框警告,提示CRS风险,因为如果管理不当,可能会变得严重或危及生命。
相关信息:
(1)Tebentafusp是一种新型双特异性蛋白,将可溶性T细胞受体融合到anti-CD3免疫效应结构域,特异性靶向黑素细胞和黑素瘤抗原gp100,这也是采用Immunocore公司ImmTAC技术平台开发的第一个分子。
(2)Tebentafusp的获批上市创造了多项行业第一,包括(1)第一个获批上市的TCR疗法;(2)第一个获批用于实体瘤的双特异性T细胞衔接蛋白;(3)第一个也是唯一一个获批用于不可切除或转移性葡萄膜黑色素瘤的药物。
(3) Immunocore公司的ImmTAC技术平台被认为有广阔的潜力,因为传统的基于抗体的免疫疗法只能靶向约10%的肿瘤表面蛋白,而TCR疗法可以靶向细胞内和细胞外几乎所有靶蛋白(>90%)。目前Immunocore管线尚未在国内开展临床试验。

2022年1月10日,Idorsia宣布FDA批准Quviviq(daridorexant)治疗失眠症。此批准基于两项3期试验(NCT03545191和NCT03575104)结果,入组了包括18个国家160多个临床试验地点的1854名成人失眠患者,主要疗效终点为从基线到第1个月和第3个月,患者进入持续性睡眠所需时间(LPS)和入睡后觉醒(WASO)的变化, 试验次要终点是患者报告的总睡眠时间(sTST)。最终结果表明:Quviviq相较于安慰剂显著改善睡眠起始和睡眠维持,以及总睡眠时间。Quviviq是一种双重食欲素受体拮抗剂,通过阻断促清醒神经肽食欲素的结合,可以抑制过度活跃的清醒状态,而不是一般的镇静大脑的治疗方法。
相关信息:
(1) Quviviq具有高脑渗透性,可快速吸收,持续时间长达8小时
(2) 2010年以后全球仅获批了4款药物用于治疗失眠症,其中三款为食欲素受体(orexin receptor)拮抗剂,仅一款Somryst为数字疗法。

信息来源:医药魔方NextPharma全球新药数据库




 个人中心
个人中心
 我是园区
我是园区













