▎药明康德内容团队报道
中国国家药品监督管理局(NMPA)官网显示,和黄医药创新药索凡替尼(surufatinib)的新适应症上市申请已正式在中国获批。公开资料显示,此次获批的适应症为:用于治疗晚期胰腺神经内分泌瘤。
此前,该产品已在中国获批用于非胰腺神经内分泌瘤(NET),并已于近期
完成
向美国FD
A滚动提交用于治疗胰腺和非胰腺神经内分泌瘤的新药上市申请(NDA)。

索凡替尼是一种新型的口服酪氨酸激酶抑制剂,具有抗血管生成和免疫调节双重活性。
索凡替尼可通过抑制血管内皮生长因子受体(VEGFR)和成纤维细胞生长因子受体(FGFR)以阻断肿瘤血管生成,并可抑制集落刺激因子1受体(CSF-1R),通过调节肿瘤相关巨噬细胞,促进机体对肿瘤细胞的免疫应答。索凡替尼独特的双重机制能产生协同抗肿瘤活性,使其成为了与其他免疫疗法联合使用的理想选择。
2020年12月底,索凡替尼首次在中国
,
用于无法手术切除的局部晚期或转移性、进展期非功能性、分化良好的非胰腺来源的神经内分泌瘤。该药因此成为继呋喹替尼之后,和黄医药第二个在中国获批上市的创新肿瘤药。
根据和黄医药早前发布的新闻稿,此次获批的新适应症上市申请,是基于成功的SANET-p临床研究数据。SANET-p是一项在中国开展的3期关键性研究,入组人群为低级别或中级别晚期胰腺神经内分泌瘤患者,这些患者目前尚无有效的治疗方法。2020年1月,该研究中期分析成功达到无进展生存期(PFS)这一预设主要疗效终点并提前终止研究。
根据刚结束的2021年美国临床肿瘤学会(ASCO)年会摘要数据,
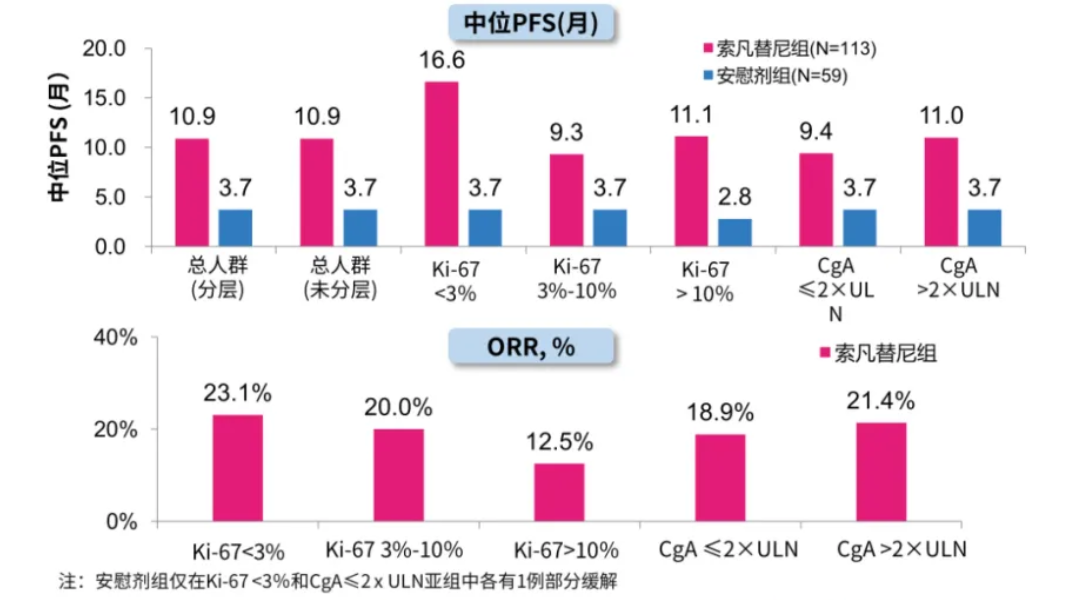
SANET-p研究共纳入172例晚期胰腺神经内分泌瘤患者。研究结果显示,在意向性治疗(ITT)人群中,索凡替尼中位PFS为10.9个月,高于安慰剂组的3.7个月。索凡替尼将患者疾病进展或死亡风险降低了51%,同时具有可控的安全性。此外,
无论Ki-67(一种肿瘤增殖标志物)表达水平或基线CgA(一种神经内分泌标志物)水平如何,索凡替尼均显示出获益。
▲
SANET-p研究
部分数据(截图来源:参考资料[3])
值得一提的是,今年5月初,和黄医药还宣布已完成向FDA滚动提交索凡替尼的
,用于治疗胰腺和非胰腺神经内分泌瘤。根据新闻稿,这是和黄医药在美国提交的首个新药上市申请。
此前,该产品已获得FDA授予治疗胰腺神经内分泌瘤的孤儿药资格,以及治疗胰腺和非胰腺神经内分泌肿瘤的两项快速通道资格,
神经内分泌瘤起源于与神经系统相互作用的细胞或产生激素的腺体。该疾病可起源于体内各个部位,最常见于消化道或肺部。神经内分泌瘤通常分为胰腺神经内分泌瘤和非胰腺神经内分泌瘤。索凡替尼可同时阻断VEGFR1-3、FGFR1和CSF-1R的独特机制,使其成为神经内分泌瘤治疗的有效药物。
祝贺索凡替尼用于胰腺神经内分泌瘤的新适应症在中国获批,希望该批准能让更多神经内分泌瘤患者获益。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局公告. Retrieved Jun 21,2021 from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210621084907105.html
[2]和黄医药完成向美国FDA提交索凡替尼用于治疗晚期神经内分泌瘤的新药上市申请. Retrieved May 03,2021, from https://mp.weixin.qq.com/s/gZYEtM8MjltbErQ9HnLCOQ
[3]【ASCO速递】和黄医药肿瘤领域研究更新 . Retrieved Jun 7,2021 from https://mp.weixin.qq.com/s/GUk4z7bT9jyBkSJLyMOwhg
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。









 个人中心
个人中心
 我是园区
我是园区




