
研究背景
在全球范围内,原发性肝癌是第七大最常发生的癌症,也是癌症死亡的第二大常见原因。肝细胞癌(HCC)是肝癌的优势类型,约占所有肝癌的75%,而肝内胆管癌(ICC)约占10%。由于肝癌通常确诊时已属晚期,导致部分切除后复发率较高,只有少数患者符合移植条件。
免疫系统的活动主要由T细胞调节。在肿瘤微环境(TME)中,抗原呈递细胞(APC)处理抗原并将其呈递给T细胞受体(TCR),此外需要共刺激信号的激活,参与T细胞反应的不同阶段(图1a)。许多癌症主要通过与T细胞表面抑制性免疫检查点(ICPs)结合的抑制性配体过表达来逃避免疫系统,从而逃避T细胞攻击(图1b)。基于上述原理,开发了ICPI作为相应ICP的单克隆抗体。它们的主要功能是阻断肿瘤细胞与免疫细胞之间的抑制信号,从而提高抗肿瘤疗效。
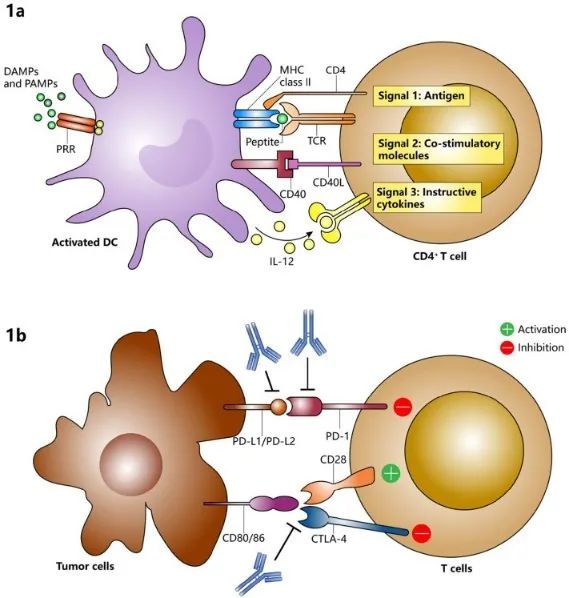
图1.T细胞激活
肝癌免疫耐受的机制
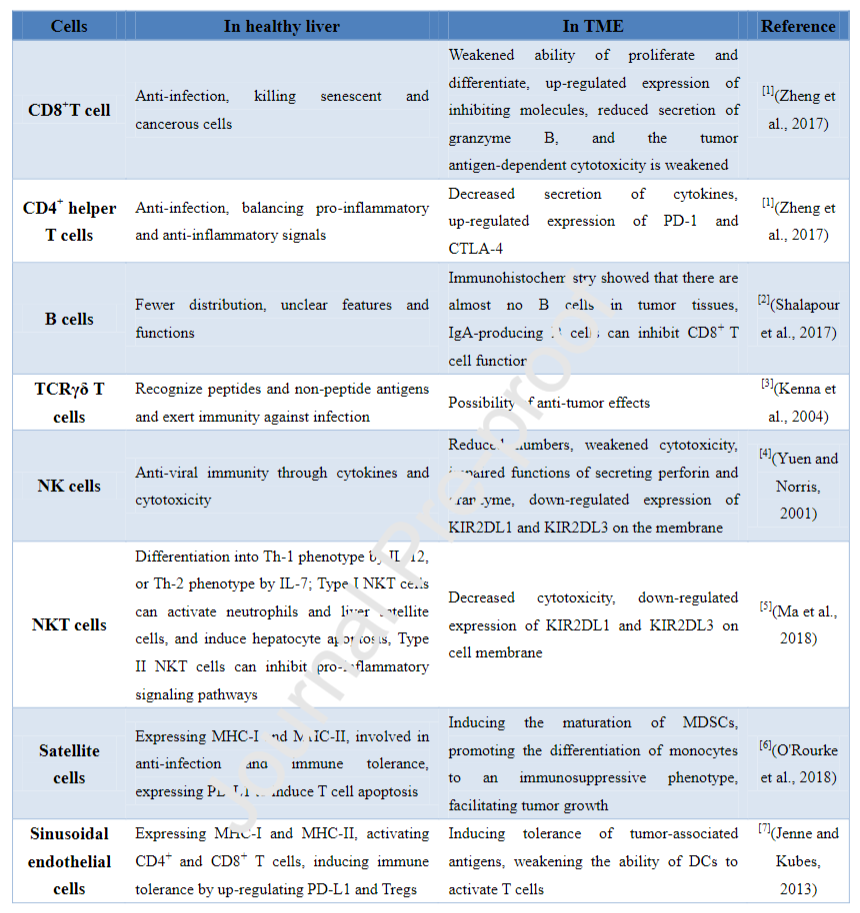
肝脏是主要由肝实质细胞组成的器官,在全身免疫调节中起着重要作用。除胆管上皮细胞外,大部分肝细胞为具有免疫功能的非实质细胞,如肝星状细胞(HSC)、巨噬细胞、自然杀伤(NK)细胞和T细胞(图2a)。肝脏也是免疫相关分子的主要产生者,包括C-反应蛋白(CRP)和可溶性模式识别受体(PRR)。与其他器官相比,肝脏需要维持高水平的免疫耐受,以保持消除肠道病原体和避免炎症之间的稳态。在炎症、纤维化和脂肪变性等病理状态下,肝脏的免疫稳态受损。免疫抑制细胞、抑制性细胞因子和免疫检查点分子增加,促进了癌症的发生(图2b)。反过来,肿瘤会诱导免疫抑制微环境的形成,从而形成恶性循环。下表为肝癌免疫微环境中其他细胞成分的总结。
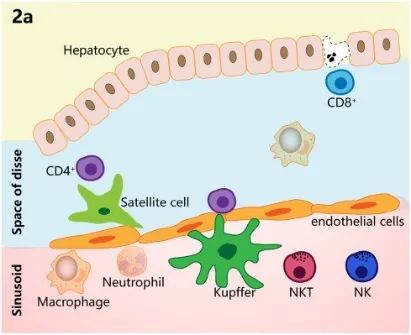
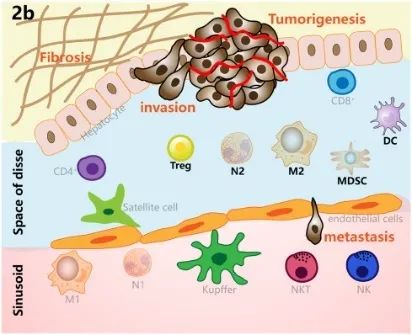
图2.肝脏和肿瘤免疫微环境
抑制性细胞因子
在肝癌的TME中,肿瘤细胞和免疫细胞分泌多种免疫抑制性细胞因子诱导免疫耐受,以TGF-β、IL-10和VEGF为代表(图3)。而Galectin-1和二肽基肽酶-4作为新型抑制性细胞因子近年来备受关注。
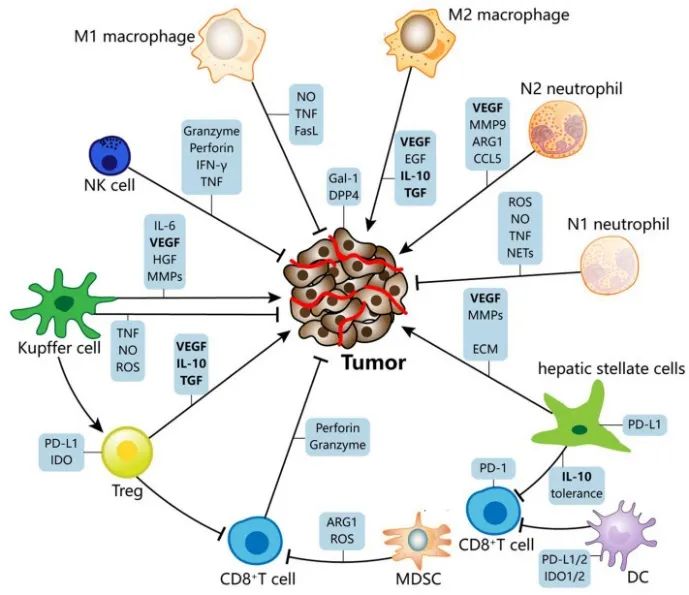
图3.TME中免疫细胞和细胞因子
TGF-β是一种多效性细胞因子,调节细胞增殖、迁移和粘附。它可以通过多种途径抑制抗肿瘤免疫,包括诱导表型不成熟的DC,诱导CD4+T细胞转化为Tregs,抑制CD8+T细胞和NK细胞的功能。
IL-10是一种抑制性细胞因子,具有广谱抗炎作用。在肝癌的TME中,IL-10可由DC、HSC、MDSCs等细胞分泌。除了对APC的影响以及抑制抗原呈递和MHC II、CD80/CD86的表达外,CD80/CD86还可直接损害T细胞功能,减少促炎细胞因子,包括IL-1、IL-6、IL-12、肿瘤坏死因子(TNF)。
目前普遍认为VEGF主要起促进血管生成的作用,但有报道VEGF可促进肝癌TME中抑制性免疫细胞的浸润和免疫检查点分子的表达。
二肽基肽酶-4(DPP4)或CD26是一种丝氨酸外肽酶,最近的研究表明,Snail/DPP4/CXCL10轴参与了HCC的免疫抑制和抗PD1治疗抵抗。据报道,DPP4对神经肽Y(NPY)的转化增强了肝癌中NPY5受体(Y5R)的激活和功能。目前,已有许多DPP4抑制剂如西格列汀、维格列汀和沙格列汀等应用于临床。已证实DPP4抑制剂西格列汀导致趋化因子CCL11浓度升高,嗜酸性粒细胞向实体瘤迁移增加。这一机制也有助于检查点抑制剂治疗的疗效。
免疫检查点受体
免疫检查点受体有很多种,其中CTLA-4、PD1、PD-L1/2、LAG-3、TIM-3和TIGIT的研究更透彻(图4)。5种受体相应的单克隆抗体都已经研发出来,其中一些已经获得FDA的批准,让患者获益良多。
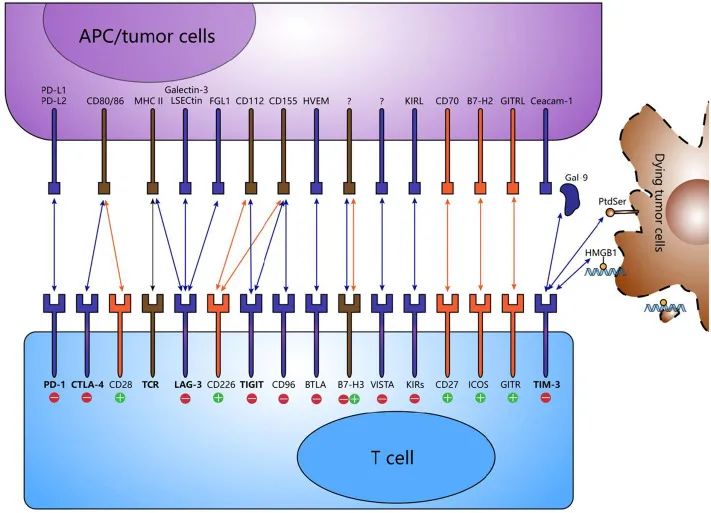
图4.当前免疫检查点受体与配体汇总
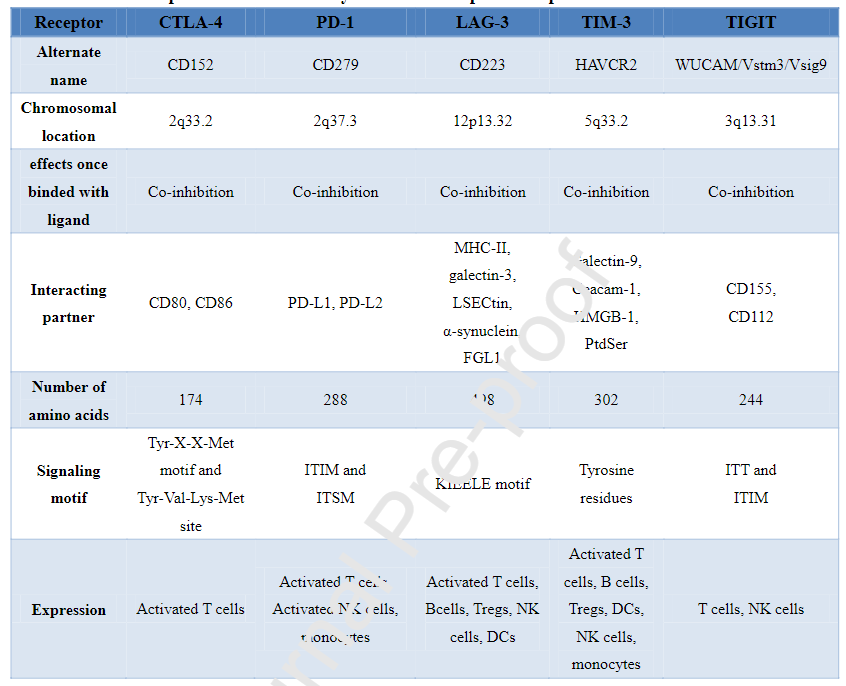
下表叙述了共抑制免疫检查点受体的特征:
ICPI应用于肝细胞癌
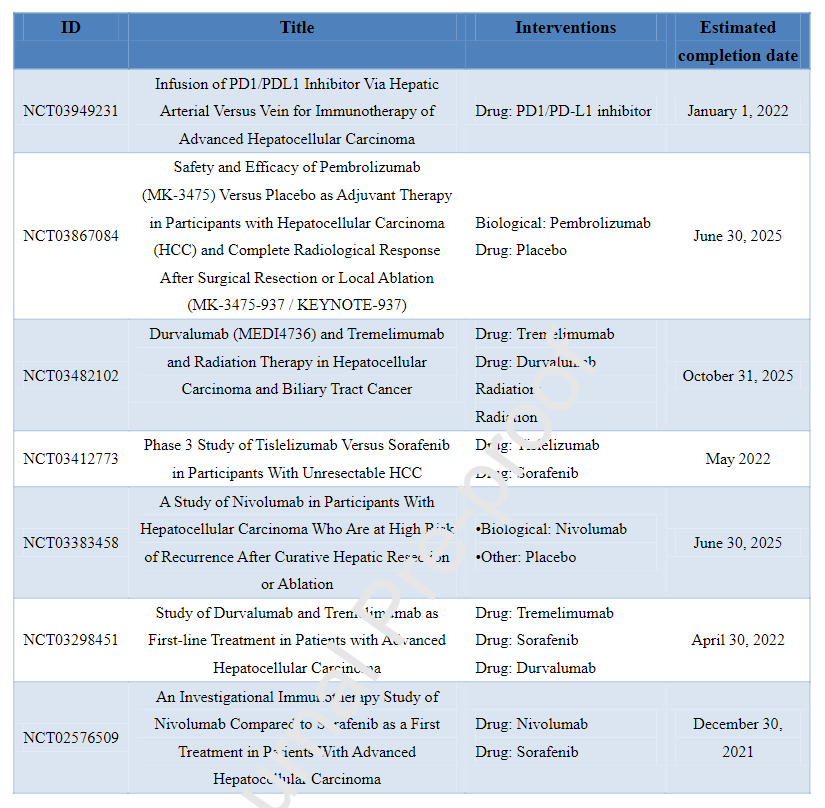
在黑色素瘤、非小细胞肺癌(NSCLC)、肾细胞癌和血液肿瘤中,ICPI显示出良好的疗效,因此在许多指南中被推荐为一线药物。由于肝癌患者的特殊情况(多数合并有肝炎、肝硬化、机体储备功能低下、肝脏失代偿、肝肿瘤微环境免疫抑制等情况),与上述疗效较好的肿瘤相比,HCC对ICPI的反应较差。ICPI作为治疗肝癌的药物仍在临床试验中进行研究。尽管如此,一些已发表的结果表明ICPI在HCC的治疗中仍具有广阔的前景。下表为当前正在使用ICPI单药治疗的III期临床试验。
ICPI联合治疗
ICPI对至少30%的肝癌患者无效,因此了解PD1/PD-L1 mAb或其他ICPI的耐药性对于改善预后至关重要。耐药机制包括肿瘤抗原免疫原性低、抗原呈递效率低、产生耗竭的T细胞、TIL与肿瘤抗原和ICPs接触不足、免疫记忆保留时间短等。因此,以下方法可用于单独或联合使用提高ICPI的疗效:
(1)释放肿瘤抗原的治疗(放疗或化疗)引发适应性免疫反应;
(2)阻断VEGF和TGF-β的抑制剂增强DC的功能;
(3)ICPIs作为肝癌切除的辅助治疗(术前降期或术后巩固);
(4)抗OX40药物改善TME,清除Tregs等免疫抑制细胞;
(5)通过靶向免疫刺激分子(如CD40或CD137)的激动剂增强T细胞功能;
(6)通过溶瘤病毒或RNA佐剂增强抗原呈递和T细胞刺激。
下表为ICPIs联合治疗HCC的临床III期研究:
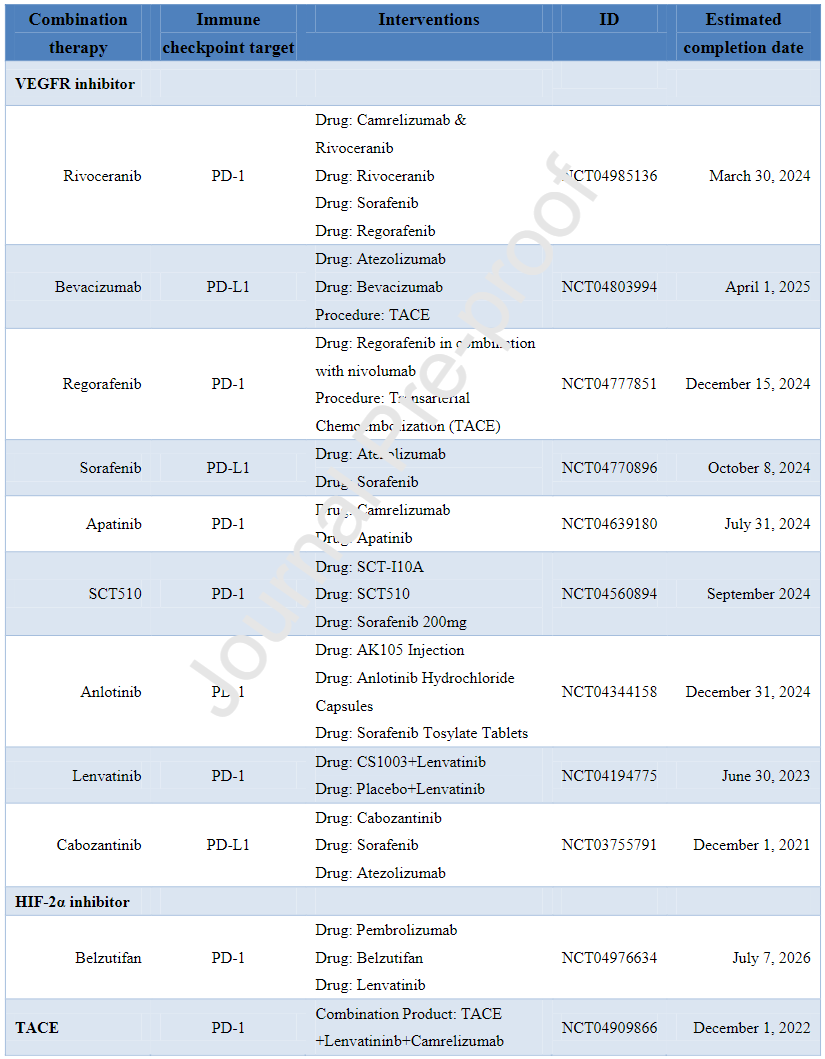
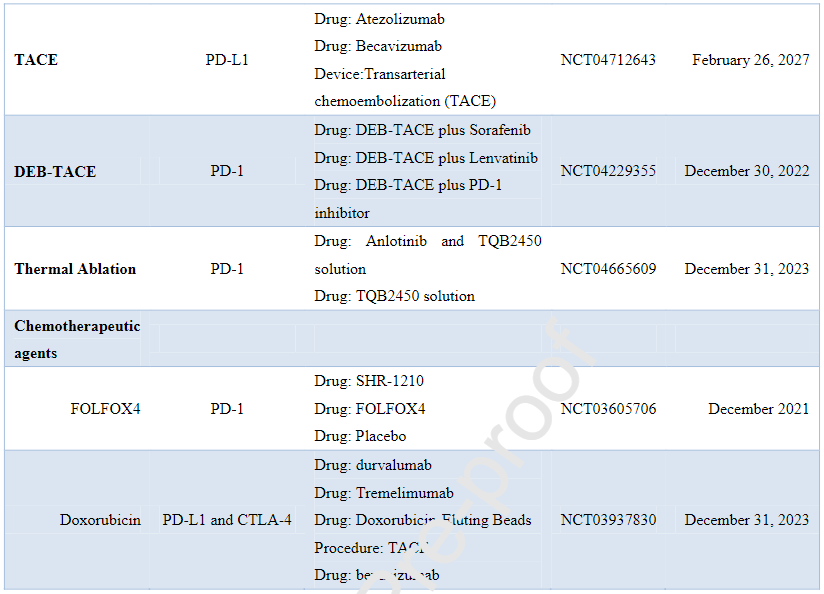
下表为ICPIs治疗肝内胆管癌的临床研究:
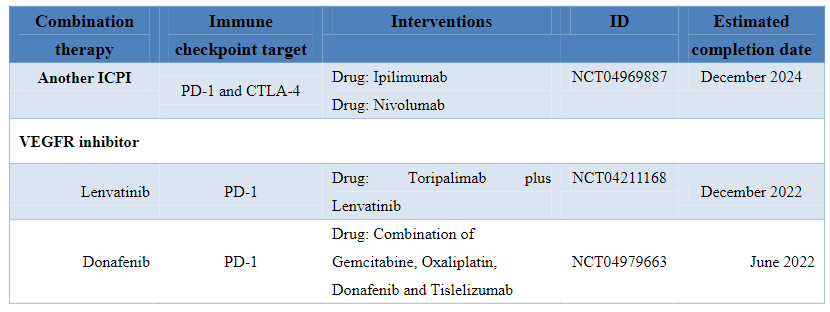
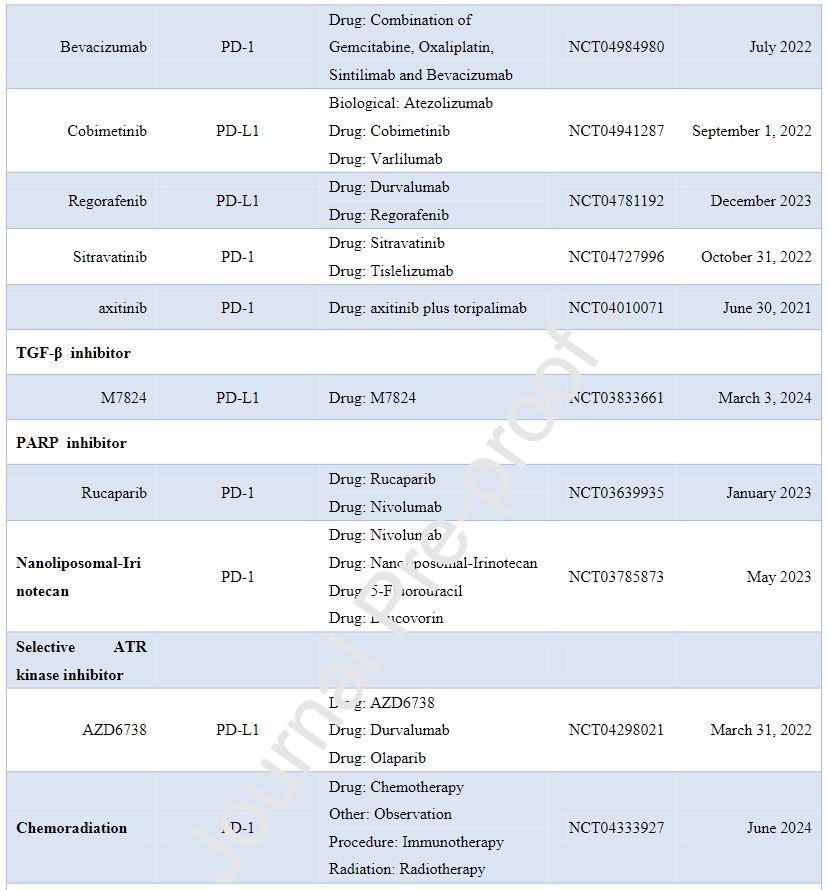
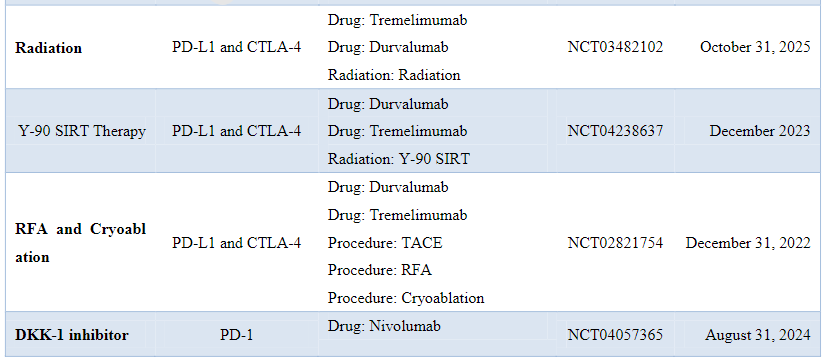
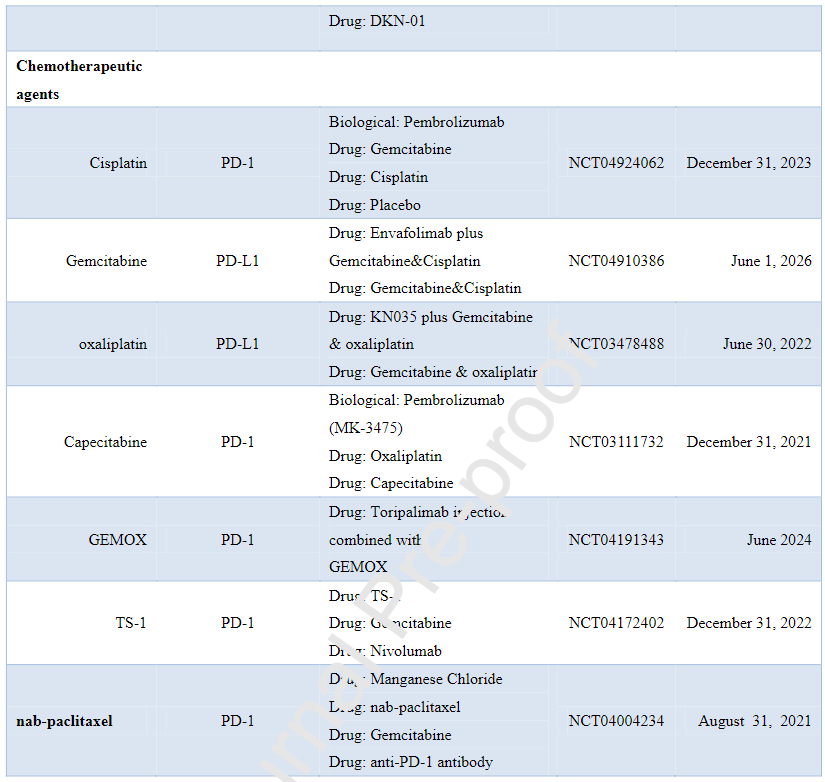
其他免疫检查点治疗包括共刺激因子(B7-1和B7-2)、表观遗传靶点以及蛋白质靶点(如eIF6)等。
小编总结
大多数肝癌确诊时已属晚期,治疗方案十分有限。只有部分患者可以接受手术切除或肝移植。以ICPI为代表的免疫治疗为不能手术的肝癌患者提供了更多的可能性。循证医学数据也显示,ICPI单药或联合治疗均可改善晚期肝癌患者的预后。新型ICPI的研发正在快速进行中。截至2021年7月,已注册的肝癌ICPI临床试验超过200项。
虽然ICPI表现出可喜的疗效,但以下问题仍有待解决:(1)由于遗传背景、病因、HCV/HBV感染、地区、种族等基础疾病等因素导致患者异质性很大,因此同一药物用于不同患者的效果差异很大。因此,在使用ICPI时,需充分考虑患者的个体差异。对于某个ICPI来说,适合人群的特点是什么?我们能否找到具有良好灵敏度和特异性的生物标志物来区分对ICPI敏感或耐药的患者?(2)ICPI治疗期间可能发生的irAE。我们如何平衡ICPI的风险和获益?(3)肝移植术后复发癌患者能否使用ICPI?如果是,最终结局是否可以改善?(4)与HCC的治疗相似,肝内胆管癌的第一个靶向药物也是酪氨酸激酶抑制剂。但ICPI对肝内胆管癌的疗效并不理想,有待进一步研究。
一般而言,肝癌患者需要进行个体化治疗,需要考虑各种因素。疗效较好的ICPIs的成功开发需要医院、科研机构、医药公司和患者的共同努力,未来可期!
参考文献




 个人中心
个人中心
 我是园区
我是园区




