
急性髓系白血病(Acute Myeloid Leukemia,AML)是一类由多基因突变导致造血干/祖细胞发生恶性转化而引起的高度异质性的血细胞肿瘤,治疗难度大且易复发。导致AML的突变基因主要包括转录因子(如RUNX1、NPM1等)、表观遗传学基因(如DNMT3、TET2等)、肿瘤抑制基因(如TP53、WT1等)和信号通路相关基因。除了参与白血病干细胞(Leukemic stem cells, LICs)的转化过程外,信号通路基因突变主要促进LIC的克隆性扩增(Clonal proliferation)而加快白血病的恶化。
受体酪氨酸激酶FLT3是AML中突变率最高的信号通路分子,由内在串联重复(Internal Tandem Duplication,ITD)插入而导致的活性突变体FLT3-ITD占所有AML病例的30%左右。作为一种膜受体,野生型FLT3主要定位在细胞膜上,与配体FLT3L结合后发生二聚化并自激活,进而活化下游的PI3K/AKT和RAS/ERK两条信号通路。与FLT3-WT不同,致癌突变体FLT3-ITD定位在内质网,而且组成型地激活STAT信号分子,该定位改变和下游信号通路的活化机制是长期以来困扰该领域的一大谜题。
2021年6月10日,费城儿童医院和宾夕法尼亚大学Perelman医学院的童为教授课题组在Blood发表了题为Depalmitoylation Rewires FLT3-ITD Signaling and Exacerbates Leukemia Progression 的研究论文。

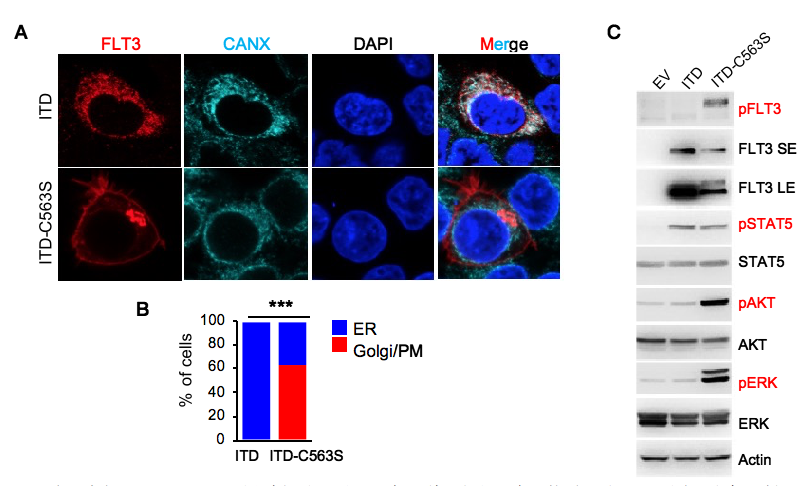
在这项工作中,作者通过对FLT3氨基酸序列的比较和生物信息学分析发现FLT3蛋白上存在潜在的棕榈酰化修饰位点。生化实验表明内外源表达的FLT3-WT、FLT3-ITD和激酶结构域的活性突变体FLT3-D835Y都会发生同等程度的棕榈酰化修饰,发生位点为第563位的半胱氨酸(C563)。有趣的是,该位点的突变会导致FLT3-ITD(FLT3-ITD/C563S)重新定位到细胞膜上,并重新激活PI3K/AKT和RAS/ERK信号通路,同时保持对STAT5的活化(图1)。令人惊讶的是,该位点突变完全不影响FLT3-WT和FLT3-D835Y突变体的定位及其对下游信号通路的活化。这些证据表明棕榈酰化修饰特异地影响致癌突变体FLT3-ITD的生物学功能。
蛋白的棕榈酰化修饰主要是由DHHC家族的棕榈酰转移酶催化。通过分别与FLT3-ITD共表达DHHC家族的23个成员,作者发现DHHC6是催化FLT3-ITD的棕榈酰化修饰的主要转移酶。与FLT3-ITD/C563S突变体的表型类似,敲低DHHC6的表达会促进FLT3-ITD的细胞膜定位、 PI3K/AKT和RAS/ERK信号通路的活化以及AML细胞的colony形成能力。目前治疗携带蛋白激酶相关基因突变的白血病或实体肿瘤的一个有效手段是小分子抑制剂,但是这类药物在临床使用中极易产生抗药性。研究人员在免疫缺陷的小鼠模型和AML患者的原代白血病细胞中证实:联合使用去棕榈酰化抑制剂和FLT3抑制剂,在减缓FLT3-ITD+ AML细胞增殖和肿瘤恶化过程中具有显著的药物协同作用,该策略为FLT3-ITD+ AML患者的治疗提供了新的思路。更重要的是,导致白血病细胞对FLT3抑制剂Gilteritinib产生抗药性的一个重要机制是RAS基因突变,由于RAS的GTP酶活性严重依赖动态的棕榈酰化修饰,因此去棕榈酰化抑制剂有望克服临床上由于RAS突变导致的对FLT3抑制剂的抗药性。
总的来说,该研究工作揭示了调控AML中致癌突变体FLT3-ITD细胞内定位的分子机制,以及对下游信号通路的活化(图3),并提出了一种新的治疗FLT3-ITD+AML的联合用药策略。重要的是,德国著名白血病专家Christian Thiede教授以Commentary的形式对该工作进行了详细点评。
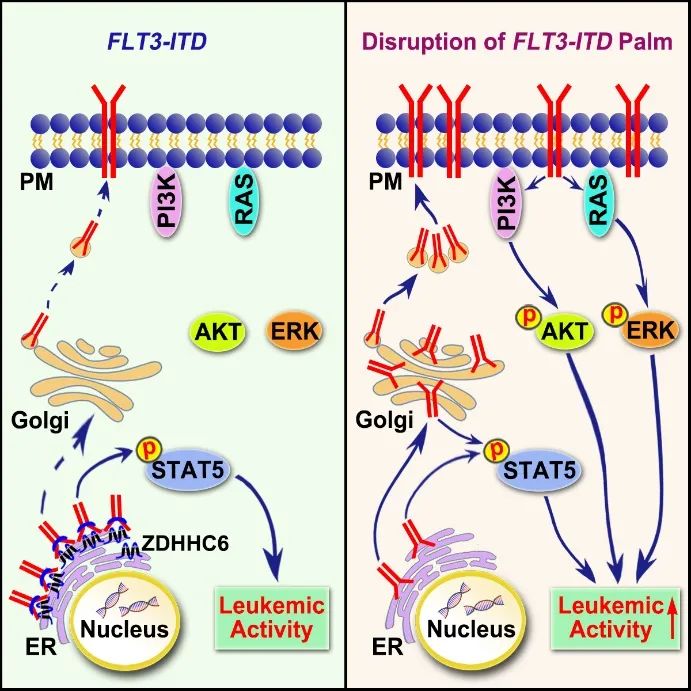
图3. 工作模型
费城儿童医院的博士后吕考升和武汉大学口腔医学院任建岗副教授为本文的共同第一作者。童为教授为本文的通讯作者。实验室致力于研究造血干细胞发育和白血病、遗传性贫血等血液病。近几年主要研究工作发表在Cell Stem Cell, Journal of Clinical Investigation, Blood, Genes Dev, Journal of Experimental Medicine等国际权威期刊,并保持稳定高效的产出。实验室目前主要研究方向为:1)探索细胞因子信号通路在维持基因组完整性和造血干细胞功能中的作用 (HSC and Fanconi Anemia);2)研究核糖体发生和装配对造血干细胞功能和骨髓衰竭综合征的影响(HSC and Ribosomopathies/Bone marrow failures);3)探索体外扩增造血干细胞的新方法(HSC and gene therapy);4)通过CRISPR筛选寻找影响白血病细胞生长及其对药物敏感性的关键基因。
实验室现招聘博士后1-2名。
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




