
人类和黑猩猩发生谱系分离后,人类前脑的大小和复杂性有所增加,从而在原始人类进化过程中达到一个新的认知功能水平。虽说细胞和解剖结构适应性由遗传变化驱动,但人们并不了解负责这一进化过程的实际遗传修饰。最近人们发现,导致基因重复的较大结构变异与人类前脑功能和进化有关【1】,且长期以来顺式调控区域的变化被认为是导致物种特异性差异的原因【2】,而两者是否共同参与大脑进化调控过程还不清楚。
在人类大脑进化中一个特别受到关注的转录因子家族是包含KRAB域的锌指蛋白 (KRAB domain-containing zinc finger proteins, KZFP),其在哺乳动物和灵长类进化过程中经历了快速扩张,人类基因组编码至少350个KZFP,其中170个为灵长类所特有。KZFPs的主要区别在于DNA结合ZF域的数量和序列,人类ZF的数量在2到40个之间不等。许多研究表明,KZFP在抑制多种细胞类型(如胚胎干细胞和神经祖细胞)中的转座因子 (transposable elements, TEs) 中发挥重要作用【3】,此外,大多数KZFPs与人类细胞中特定的TE家族结合,这些发现使KZFPs成为解释人类和黑猩猩大脑之间进化差异的有力候选者,但目前仍缺乏直接证据。
近日,来自瑞典隆德大学的Johan Jakobsson团队在Cell Stem Cell杂志上发表了一篇题为A cis-acting structural variation at the ZNF558 locus controls a gene regulatory network in human brain development 的文章,这项研究鉴定了一种在人类而非黑猩猩前脑祖细胞中表达的KZFP——ZNF558,其表达受可变数目串联重复序列(variable number tandem repeat, VNTR)的大小控制,从而调节线粒体自噬基因SPATA18的表达,影响人类大脑早期发育过程中的发育时间。这种VNTR序列在黑猩猩中更长,但在人类中更多变,这些发现可能提供了对顺式作用结构变异如何建立影响人类大脑进化的调节网络的机制见解。

为了直接比较人类和黑猩猩的前脑神经祖细胞(forebrain neural progenitor cells, fbNPCs),该团队基于iPSCs技术建立了一个优化的体外细胞培养模型,并通过免疫细胞化学、批量和单细胞RNA-seq证实模型系统的可用性。在差异表达基因中,基于KZFP转录因子作为控制物种特异性差异的特性,该团队着重关注KZFP家族,并选择仅在人类样本中唯一且高表达的ZNF558进行进一步分析。
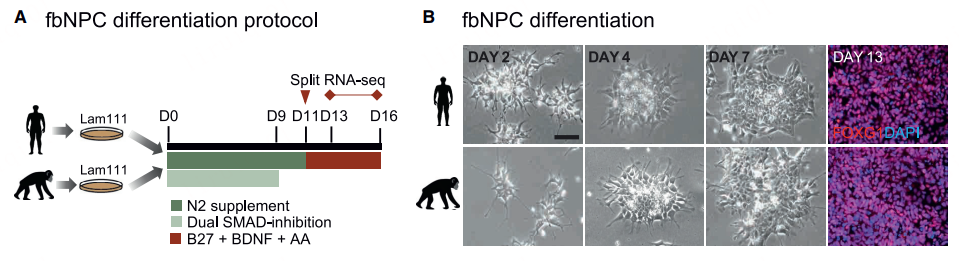
图1. 人类和黑猩猩fbNPCs诱导分化方法示意图
为了研究ZNF558在人类fbNPCs中的功能相关性,该团队设计了一种CRISPRi 策略来沉默ZNF558的表达。RNA-seq分析显示,线粒体自噬基因SPATA18在ZNF558沉默时上调,与此一致的是,CUT&RUN表明激活相关表观遗传标记H3K4me3在ZNF558启动子上完全丢失,而唯一获得该组蛋白标记的ZNF558结合位点即为SPATA18的结合位点。此外,根据体外模型和大脑类器官的RNA-seq分析显示,人类和黑猩猩大脑发育中ZNF558差异表达的功能结果是对单个基因SPATA18的抑制。
作为线粒体自噬基因,SPATA18的蛋白表达产物有助于通过线粒体自噬降解线粒体。有趣的是,最近一项观察将线粒体功能与人类大脑皮层的形成和扩张直接联系起来【4】,且在本研究中ZNF558沉默也会引起人类fbNPCs中线粒体含量的显著下降。为了研究ZNF558在人类大脑发育中的功能作用,该团队生成了ZNF558缺陷的大脑类器官。与对照组相比,ZNF558的缺陷并不会对细胞类型产生影响,但ZNF558缺陷类器官在早期分化阶段体积较小,显示出更成熟的转录谱,这些发现表明,ZNF558不影响大脑发育命运,但会影响发育进程。
鉴于ZNF558在人和黑猩猩之间是保守的,该团队接下来探索了这两个物种之间差异表达的潜在遗传基础。该团队利用来自公开数据集的1112个高覆盖人类和类人猿基因组数据研究该基因组的拷贝数变异,确定了一个长度为7460 bp的 VNTR基序,其在人类和非人灵长类动物间显示出惊人的拷贝数差异。有趣的是,ZNF558的表达与VNTR拷贝数呈负相关,且这种相关性为ZNF558所独有,位于VNTR 250 kb内的其他基因表达与拷贝数无关。RNA-seq分析显示人类而非黑猩猩fbNPCs中存在VNTR lncRNA的证据。为了进一步测试VNTR的顺式抑制模型,该团队通过CRISPRi策略对较短的人类VNTR施加沉默,可以观察到VNTR沉默后,VNTR lncRNA表达降低,且ZNF558表现出转录的强烈抑制,这反过来导致SPATA18转录水平增加。
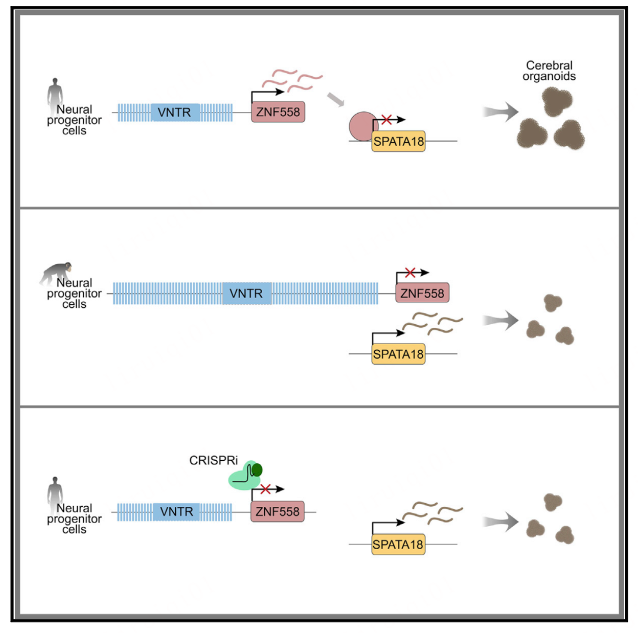
总之,这项工作说明了ZNF558这种KZFP如何对人类大脑进化做出贡献。迄今为止,表明顺式作用调节元件的变化对人类大脑进化很重要的证据仍然有限,而这项研究展示了非编码区域的遗传变异如何控制保守的蛋白质编码基因的活性,从而建立物种特异性的转录网络。
参考文献
1. Enard, W. (2016). The Molecular Basis of Human Brain Evolution. Curr. Biol. 26, R1109–R1117.
2. King, M.C., and Wilson, A.C. (1975). Evolution at two levels in humans and chimpanzees. Science 188, 107–116.
3. Bratta˚ s, P.L., Jo¨ nsson, M.E., Fasching, L., Nelander Wahlestedt, J., Shahsavani, M., Falk, R., Falk, A., Jern, P., Parmar, M., and Jakobsson, J. (2017). TRIM28 Controls a Gene Regulatory Network Based on Endogenous Retroviruses in Human Neural Progenitor Cells. Cell Rep. 18, 1–11.
4. Namba, T., Do´ czi, J., Pinson, A., Xing, L., Kalebic, N., Wilsch-Brauninger, M., € Long, K.R., Vaid, S., Lauer, J., Bogdanova, A., et al. (2020). Human-Specific ARHGAP11B Acts in Mitochondria to Expand Neocortical Progenitors by Glutaminolysis. Neuron 105, 867–881.e9.
转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




