人工智能是药物研发的强大加速器,在降低研发成本的同时能大幅缩短新药上市周期。目前自然语言处理、机器学习、深度学习、知识图谱等人工智能关键技术在药物靶点发现、活性化合物筛选、分子生成等新药研发环节已得到广泛应用,全球多家人工智能企业与制药企业已开启深度合作模式。但人工智能应用在药物研发领域的应用仍存在人工智能监管法规缺位、制药企业技术创新效率未达预期以及研发各方未形成有效合力的困境,施行监管与非监管并行措施、合理选择药物研发路径、搭建政产学研用协同生态系统等有助于我国医药产业高质量发展。
人工智能;药物设计;跨学科配置;制药工业;政府政策
据统计 2009 年至 2018 年期间美国食品和药物管理局(FDA)批准上市的 355种新药研发支出为 3.14 ~28 亿美元[1]。2005 年至 2016 年药物各个阶段临床试验成功率分别为Ⅰ期 3.4%~32.6%、Ⅱ期 6.7%~35.1%、Ⅲ期 35.5%~75.3%、Ⅳ期80.3%~84.9%[2],药物平均上市周期为 13.5 年[3]。有研究表明十年前投入研发的每1 美元都有 10 美分回报,而如今其收益不到 2 美分[4]。可见研发成本高、周期长、回报率低是掣肘制药企业新药开发的三座大山。科技公司 Tech Emergence 研究发现新药研发搭载人工智能后速率提高 2%[5],高盛集团(Goldman Sachs)在报告中指出人工智能技术成熟后有望在新药研发领域每年降低 280 亿美元成本[6]。市场研究机构 Infoholic Research LLP 的一份市场报告显示,2020 年人工智能在药物研发领域的市场价值已达到 3.4378 亿美元,预计复合年增长率为 43.24%[7]。
世界各国高度重视人工智能技术发展,纷纷发布战略性文件及相关政策激发企业创新活力,譬如美国《国家人工智能研发战略计划》、欧盟《欧盟人工智能》、英国《产业战略——人工智能领域行动》、德国《联邦政府人工智能战略要点》、法国《人工智能战略》、日本《人工智能技术战略》、我国《新一代人工智能发展规划》等文件,均强调要加大人工智能领域投入,力争技术与应用达到世界领先水平。在良好的政策环境下,诸多制药企业已与人工智能公司合作,开启新一轮的新药市场角逐,以期赢得技术红利。本文梳理人工智能在药物研发领域的应用进展,剖析人工智能+药物研发的卡脖子问题,提出行业发展建议,为我国医药行业谋篇布局提供借鉴与参考。
新药研发涉及系统生物学、药理学、生物信息学、分子生物学、药物化学、医学等多学科知识,复杂程度极高,未知性极强。人工智能领域中的自然语言处理(natural language processing)、机器学习(machine learning)、深度学习(deep learning)、知识图谱(knowledge graph)、计算机视觉(computer vision)等相关技术,有助于解决药物研发领域沉疴多年的问题。人工智能通过模仿人脑智能活动,从海量医学知识提取关键有用信息,构建复杂信息处理模型预测研发方向,该技术在蛋白结构及蛋白配体相互作用预测、药物靶点发现、活性化合物筛选、分子生成、化合物性质预测、临床试验、生物标志物研究、药物重定向等环节均已得到广泛应用[8-12],各个环节常用的人工智能方法详见图 1。
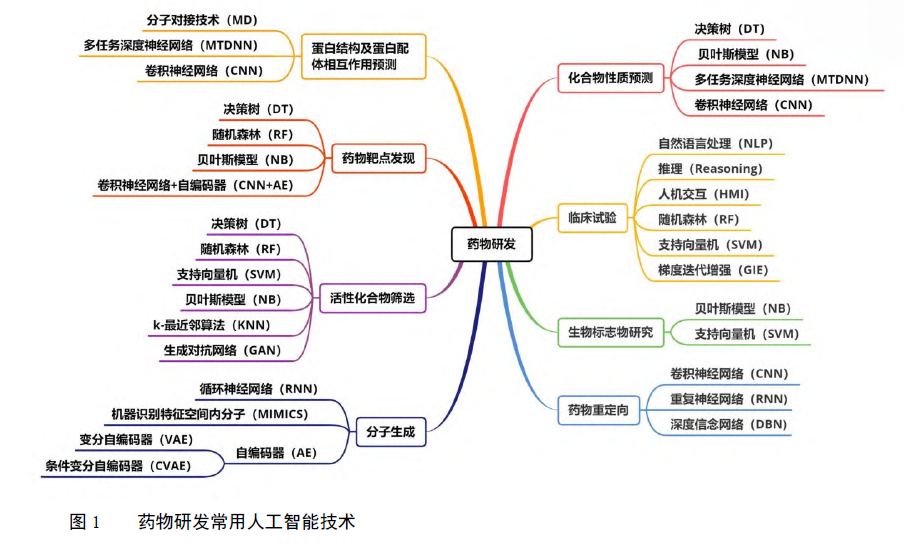
2 典型人工智能企业新药研发进展
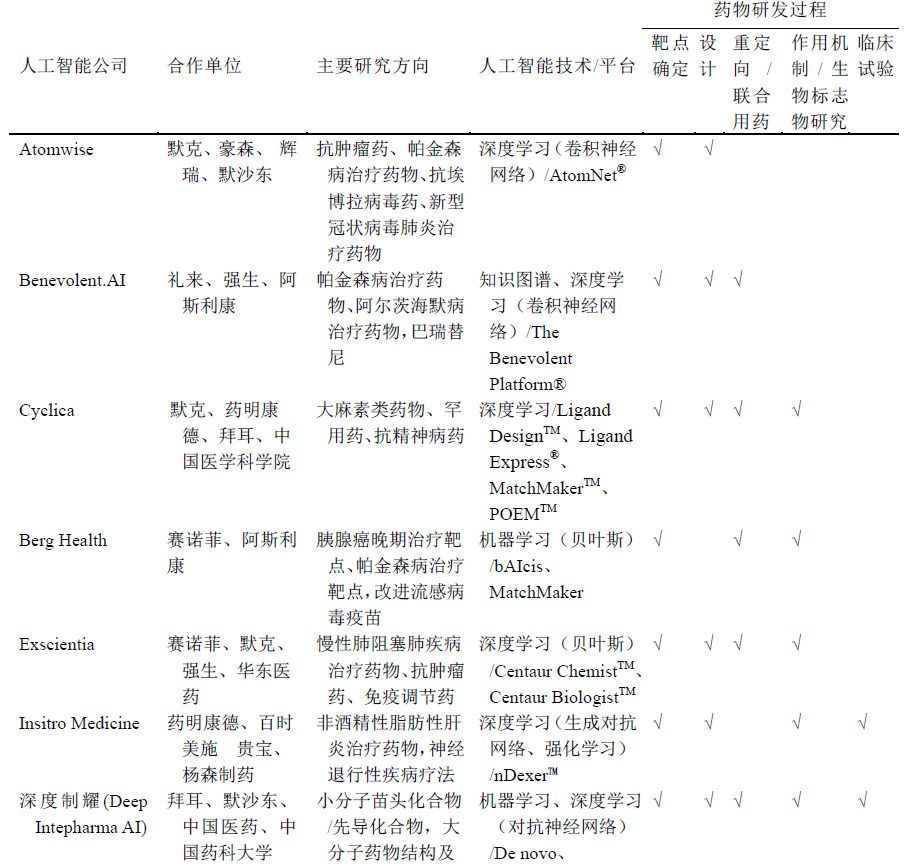
全球多家人工智能企业与制药企业开启深度 合作模式,利用自主设计的人工智能技术平台助力制药企业研发抗肿瘤药和免疫 调节药、神经系统药物、抗感染药物、呼吸系统药物、罕用药等多种药物,当前 已渗透到整条研发管线,见表 1
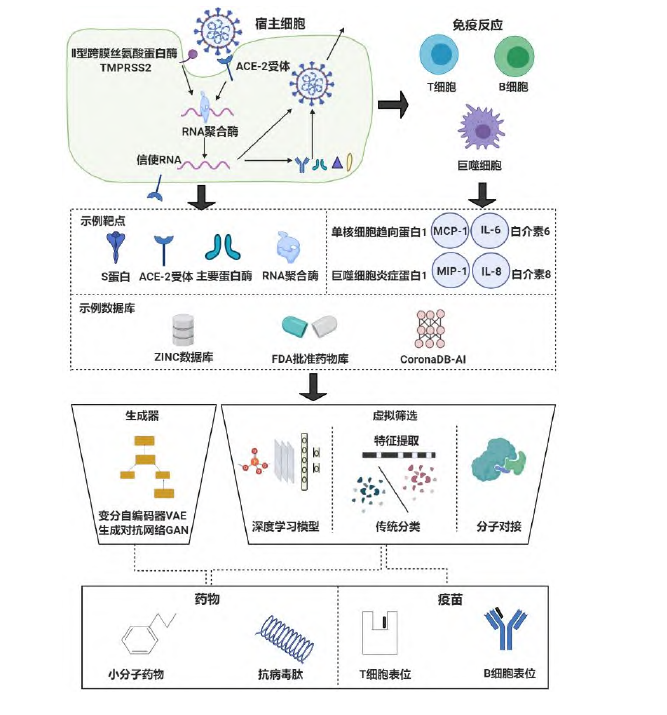
美国药物设计公司 Atomwise 拥有的 AtomNet®是第一个基于结构的虚拟药物 发现平台,该技术利用卷积神经网络能在数周或数月内筛选出小分子候选药物, 还能解锁多个无成药性靶点。Atomwise 正与全球 250 多个合作方开展 775 个项目,应对 600 多个独特的疾病目标,包括肿瘤(38%)、传染病(26%)、神经系统疾病(8%)、心血管疾病(5%)、免疫性疾病(4%)、内分泌系统和新陈代谢性疾病(4%)、罕见病(3%)、生物学(2%)及其他(10%)。Atomwise 与中佛罗里达大学、剑桥大学、亚利桑那大学和加州大学合作团队应用人工智能研究了新型冠状病毒肺炎(COVID-19)药物发现和疫苗研发管线(详见图 2)。该研究团队通过研究 ZINC 数据库(小分子结构数据库)、LOPAC 数据库(药理活性化合物数据库,含 1 280 个已知生物活性小分子和 300 个 FDA 批准的药物)[13]、SWEETLEAD 数据库(含计算机辅助药物发现的批准药物、受管制药物和草药分离物的数据库)[14]、Drugs-lib 数据库(含 7 173 种上市药物数据库)[15]与文献、在线资源等,梳理出了计算机模拟或体外发现的治疗 COVID-19 的小分子、多肽和表位的数据集列表“CoronaDB-AI”,通过生成器(变分自编码器 VAE 或生成对抗网络 GAN)和药物虚拟筛选平台(深度学习模型、特征提取、分子对接技术)发现小分子药物与抗病毒肽、T 细胞表位疫苗和 B 细胞表位疫苗。

欧洲最大的新药研发独角兽公司 Benevolent.AI 使用英伟达超级计算机DGX-1,应用 Benevolent Platform®平台模拟大脑皮层识别和学习模式,能够在海量数据与信息源之间建立新关系,更高效地产生更多创新药物。2020 年 2 月该公司利用人工智能工具和生物医学知识图谱帮助礼来制药公司发现了 COVID-19 潜在抗病毒药物巴瑞替尼(baricitinib),于同年 11 月宣布巴瑞替尼与瑞德西韦联合用药达到研究终点,与单独瑞德西韦用药相比显著缩短患者康复时间[17]。该药物已进入Ⅲ期临床试验(NCT04421027),研究设计为随机、双盲、安慰剂平行对照试验,研究药物对 COVID-19 住院患者的有效性。Benevolent.AI 助力强生公司研发的治疗帕金森病患者白日过度嗜睡药物 bavisant 已进入Ⅱ期临床试验(NCT03194217),研究设计为多国、多中心、随机、双盲、安慰剂对照试验,研究目的是比较 0.5、1 和 3 mg·d-1 三种剂量 bavisant 的有效性和安全性。该公司研究的特应性皮炎药物已经入Ⅰ期临床试验,肌萎缩侧索硬化病靶点 1 和 2、溃疡性结肠炎靶点 1 和 2、胶质母细胞瘤靶点正在先导化合物优化阶段,与阿斯利康合作的慢性肾脏病、特发性肺纤维化药物研发处于靶点确立阶段,对阿尔茨海默病、罕见病等疾病亦有所研究。
加拿大生物技术公司 Cyclica 开发的 Ligand DesignTM和 Ligand Express®药物发现云计算平台提供了一个完整的端到端平台,利用人工智能、生物分子数据、计算生物物理学知识帮助研究人员设计筛选创新、安全的类药物分子。在MatchMakerTM和 POEMTM技术运作下,Ligand DesignTM平台通过分子库筛选、半生成式探索、全生成式探索三种方式快速探索化学空间,在满足多种参数要求的前提下识别新化学物质。Ligand Express®平台结合分子生物物理学与深度学习方法掌握小分子药物如何与体内所有蛋白质相互作用,进而预测靶点和非靶点多重药理学特性、ADMET 性质、配伍禁忌等关键信息,实现药物优选(drug optimisation)、药物重定向(drug repurposing)及药物作用机制阐释(MOA elucidation)(如表型筛选反卷积)。强大的 POEMTM 技术应用非参数监督学习方法(parameter-free supervised learning),减少机器学习过拟合风险,且可解释性强。该公司近几年主要开发大麻素类药物、罕用药、抗精神病药。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
人工智能是助力药物研发的工具,存在性能风险(错误风险、偏见风险、不透明风险、性能不稳定风险、缺乏反馈过7程风险等)、安全风险(网络入侵风险、隐私风险、开放源码软件风险、对手攻击风险等)及控制风险(失控风险、无法控制恶意人工智能风险等)。诚然在无法律法规约束阶段有利于企业释放研发活力,但当前药物研发中所应用的人工智能软件并未列入特定的产品类别予以合理监管,加之医疗人工智能法律主体地位不明朗、评价标准与方法规范缺失、侵权责任归属复杂性问题凸显,衍变为行业发展的首要障碍[18]。研发工具缺乏统一的独立测试数据库及有效的评价标准,容易引发无序竞争、恶意竞争、低水平重复建设等问题。在企业风险防控意识匮乏的前提下,不利于企业识别研发软件偏差和歧视,影响输出结果的精确度和准确度。
药物研发所用的医学、化学和生物数据通常是稀疏、有噪声、有偏差和不一致的,还有很多非结构化医疗保健数据和互不通信的异类数据源,数据标注水平参差不齐,这会影响到训练效果及不同模型质量优劣的衡量,增加研发不确定性,同样会导致失败。人工智能算法带有涌现性和自主性,算法输出结果难以预测与解释[19],缺乏透明度,研发人员无法知晓虚拟筛选所得小分子药物优先排位的缘由与依据,可能连设计者都无法解释,这就是“黑箱现象”。然而人工智能的准确度和透明度恰恰成反比,要解决黑箱问题需要在两者间进行权衡。总之,数据质量问题与算法黑箱会导致药物研发的不确定性,从而影响企业技术创新效率。IBM 公司的 Watson 肿瘤解决方案(Watson for Oncology)因给出意见的过程和底层技术上存在严重问题而常给患者提供错误治疗方案,行业对该公司技术产生质疑。随后因药物研发工具 Watson for Drug Discovery市场表现不佳,公司决定停止开发和销售[20]。
当前诸多公司已进入人工智能赋能药物研发的赛道,但是制药企业与人工智能企业之间的合作模式并不成熟,双方有碍于各自医学数据与技术保密性,会处于偏保守谨慎的心态,部分企业出现缺乏开放合作的态度。此外,鉴于涉及多个学科交叉,复合型人才极度匮乏,药物研发团队与人工智能企业团队之间尚处于磨合期,研发端对药物研发期望与人工智能技术现实产出存在落差,可见人工智能应用场景落地困难重重。光凭制药企业自身实力开展新药研发,可谓势单力薄,如何更高效地利用各方优势开展顺畅的双向沟通,形成一股合力,开发出既具强创新性、又能实现个性化精准治疗的药物,仍是一个难题。
安全可靠的人工智能系统应该是可验证的、可审计的、可解释的、无偏的和健壮的,而当前既要避免技术偏差、失控等问题引发不可逆的损失,防范潜在风险扩大化,又要避免过度监管抑制企业创新。建议国家以非监管措施先行先试,譬如出台人工智能药物研发政策指南或框架,制定自愿性行业共识标准,构建标准数据库,规定高质量数据库的要求,再出台法律法规,确立市场准入条件,设立安全港试点计划,引导行业有序规范发展。同时开展分类分级监管[21],实行宽严有别的管理方式,尤其关注人工智能对研发带来的预期收益与预期成本,选用收益大过成本的研究方案,舍弃或避免使用得不偿失的方案,借助新兴技术实现精准医疗,为患者提供个性化医疗服务。建议施行算法问责制度,要求人工智能企业开发可解释的人工智能(explainable AI,XAI),严格审计机器学习系统偏差,及时启动纠偏措施,针对研发软件出现的失准预测或相关后果问题,建立算法责任分配机制和补偿救济机制,实现负责任的、可追溯的、可理解的人工智能。
我国制药企业以仿制为主,受到多方因素影响尚未形成创新药研发产业链条,而人工智能赋能药物研发的成本优势尤为明显,恰好能在一定程度上规避企业因研发资金短缺对新药研发望而怯步的棘手问题。目前,若干大型企业已携手人工智能公司展开研发工作,如江苏豪森与 Atomwise 合作开发抗肿瘤及其他领域小分子药物,正大天晴借助阿里云虚拟筛选工具后,药物筛选准确率提高 20%[22]。中小型制药企业可以尝试利用人工智能技术开展药物重定位,拓展药物用途,预计能将产品上市时间缩短 3~12 年[23],研发成本降低 50%~60%[24,25]。企业可以充分利用 TensorflowTM、Keras、Deepchem、PyTorch、Caffe2等开源系统框架,选择框架内已有模型进行数据训练得到模型参数,也可以调用框架函数接口使用自定义的新算法。企业可以在资金能力允许范围内有偿使用人工智能企业商用数据库,搜集海量医学数据,过滤原始输入数据以提升数据质量,利用多年研发数据、真实世界数据以及医学、生物学、多重药理学等知识开展研究。企业可从老药新用逐步过渡到新药从头设计或者两者并行,寻找研发新突破点,抓住市场契机。
人工智能应用在药物研发领域时间并不算长久,单凭企业个体单打独斗,耗时耗力,产出效率低,建议搭建政产学研用协同生态系统,开启多方主体协同创新、协同治理新模式。整个生态系统内各个主体可以共享海量优质数据资源,互通技术方法,共同协作打通创新链、产业链、价9值链,营造研发领域发展新生态。政府既是掌舵人,又是架起多方主体合作的桥梁,引导、服务与监管企业合法合理使用人工智能进行药物研发;产业是药物研发主赛场,也是检验人工智能应用效果的试金石;高校主导知识创新和技术创新服务,培养多元复合型应用人才;科研机构扮演技术引领的角色,适时实现成果转化;用户(患者)对新药临床效果做出及时反馈,逐步接受与信任可控可靠的人工智能。
本公众号发布的文章均为促进制药界同行的交流与学习;未用于任何商业用途。我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。


















 个人中心
个人中心
 我是园区
我是园区




