您还不是认证园区!
赶快前去认证园区吧!
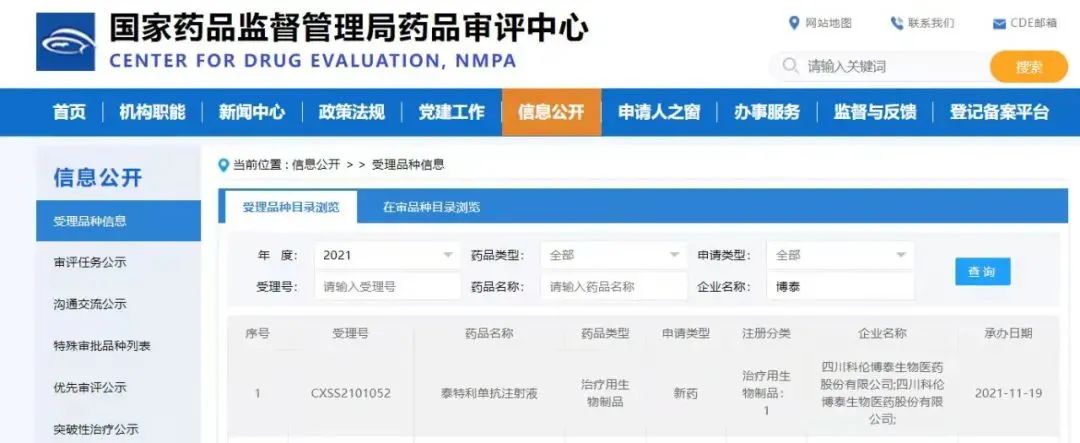
11月19日,CDE承办了四川科伦博泰生物医药股份有限公司研发的1类生物制品泰特利单抗注射液(产品代号:KL-A167)的临床申请。
目前国内尚无具有自主知识产权的国产PD-L1单抗获批,而该款却是全球首个拥有自主知识产权的PD-L1单抗(拟定适应症为“用于治疗既往接受过二线及以上化疗失败的复发或转移性鼻咽癌”)。

 药选址
药选址11月19日,CDE承办了四川科伦博泰生物医药股份有限公司研发的1类生物制品泰特利单抗注射液(产品代号:KL-A167)的临床申请。
目前国内尚无具有自主知识产权的国产PD-L1单抗获批,而该款却是全球首个拥有自主知识产权的PD-L1单抗(拟定适应症为“用于治疗既往接受过二线及以上化疗失败的复发或转移性鼻咽癌”)。

