全球首创!康方生物PD-1/CTLA-4双抗治疗宫颈癌获美国FDA孤儿药认定
收藏
关键词:
孤儿药癌FDA生物药PD-1治疗
资讯来源:生物探索 + 订阅账号
发布时间:
2021-02-24
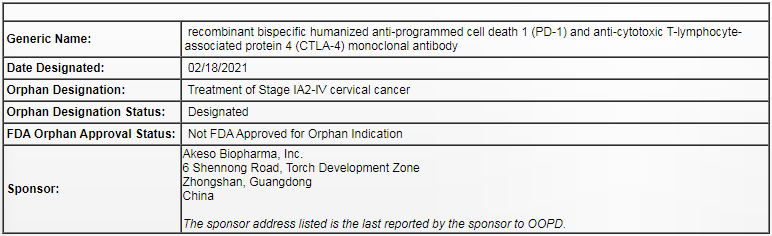
2月23日,康方生物(9926.HK)宣布, 旗下PD-1/CTLA-4双特异性抗体Cadonilimab获得美国食品药品监督管理局(FDA)授予的孤儿药资格认定,用于治疗宫颈癌(除极早期IA1期之外)。
这是继2020年Cadonilimab治疗经标准治疗后的复发或转移性宫颈癌获得FDA授予快速审批通道资格(FTD)和国家药品监督管理局(NMPA)授予“突破性治疗药物品种”后,该产品获得的又一项重要进展。
含铂药物化疗治疗失败的宫颈癌患者,目前尚无获批的标准治疗。后线化疗治疗的客观缓解率(ORR)不足10%,无进展生存时间短,长期化疗耐受性差,不良反应发生率较高,极需要有效的治疗药物来提高患者的疗效获益。
Cadonilimab是康方生物通过其专有TETRABODY技术自主设计的四价双抗,同时靶向程序性细胞死亡蛋白 1(PD-1) 及细胞毒性T淋巴细胞相关蛋白 4(CTLA-4)。作为全球首创的新型肿瘤免疫治疗双特异性抗体新药,该产品旨在实现与肿瘤浸润淋巴细胞(TIL),而不是正常外周组织淋巴细胞的优先结合,有较好的靶向性。
据公开资料显示,PD-1和CTLA-4联合治疗对肾细胞癌、胃癌、小细胞肺癌等某些难以治疗的癌症类型产生了显著改善的总体缓解率(ORR),但是这种联合疗法存在较为明显的毒副作用,因此该联合疗法未得到广泛应用。而这款PD-1/CTLA-4双抗似乎能够获得了比联合疗法更好的疗效,同时又大幅降低了毒副作用。
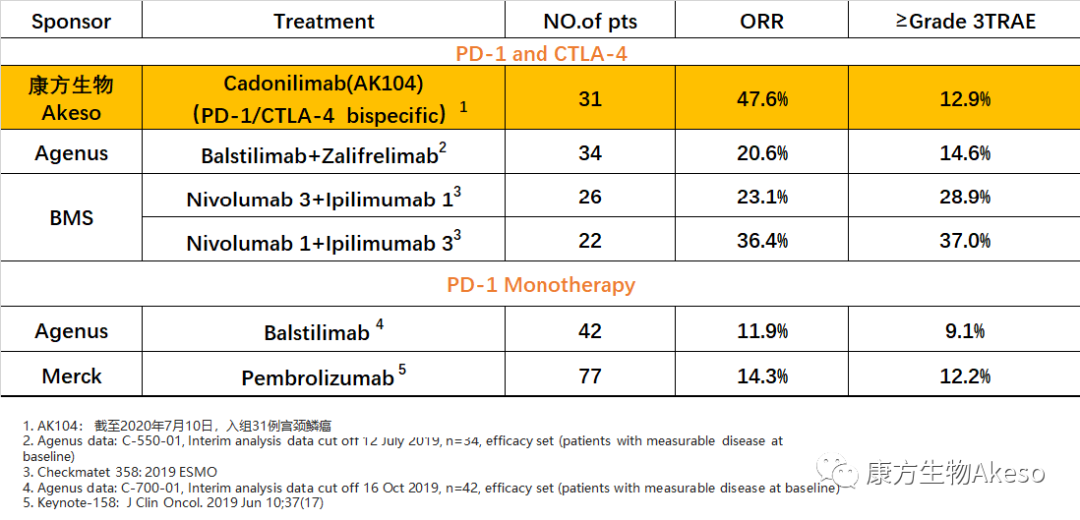
2020年11月,康方生物公布了Cadonilimab阶段性数据,显示在复发或转移性宫颈鳞癌患者中的客观缓解率(ORR)达47.6%。当前Balstilimab+Zalifrelimab以及Nivolumab+Ipilimumab这两款备受业界关注的PD-1+CTLA-4联合疗法,ORR分别为20.6%以及23.1%~36.4%。可见Cadonilimab疗效的显著性。
不仅是治疗效果优异,Cadonilimab的安全性数据也令人欣喜。3级及以上药物相关不良事件(TRAE)的发生率仅为12.9%,安全性与PD-1单药相当,而Nivolumab+Ipilimumab联合用药的TRAE数据为28.9%~37.0%。
根据《孤儿药法案》,凡获得孤儿药资格的候选药物,有机会获得7年市场独占权,以及FDA提供的税收减免、生物制品许可证申报费减免、处方药用户费用减免、研发资助、方案协助和快速监管审批通道等一系列配套支持政策。此次康方生物Cadonilimab获得孤儿药资格认定,无疑将为加速该产品的上市进程,为广大患者带来更加高效的治疗选择。
免疫疗法 | 生物仿制药 | 疫苗 | 耐药性 | 药物靶点 | 健康生活 | 药企新闻 | 药物盘点 | 制药技术 | 药物副作用
白血病
| 肺癌
| 胃癌
| 结直肠癌
| 肝癌
| 乳腺癌
| 胰腺癌
| 心血管疾病
| 神经退行性疾病
| 肠道微生物
体外诊断
| 医疗器械
| 生物纳米
| 3D打印
| 基因检测
| 单细胞测序
| 基因编辑
| 辅助生殖
| 人工智能
| 精准医学
抗癌药
| 4+7带量采购
| 耗材
| 备案制
| 注册人制度
| 健康中国
| 新版基药目录
| AI医疗器械
| 远程医疗
| 同股不同权
IPO
| 融资
| 合作
| 基金
| 港交所
| 科创板
| 创业板
| 研发投入
| 收购
| 市场&消费




 个人中心
个人中心
 我是园区
我是园区




