罕见病 | 百济神州引进的司妥昔单抗即将获批,治疗特发性多中心Castleman病
收藏
关键词:
单抗治疗罕见病获批百济神州
资讯来源:药渡 + 订阅账号
发布时间:
2021-11-25
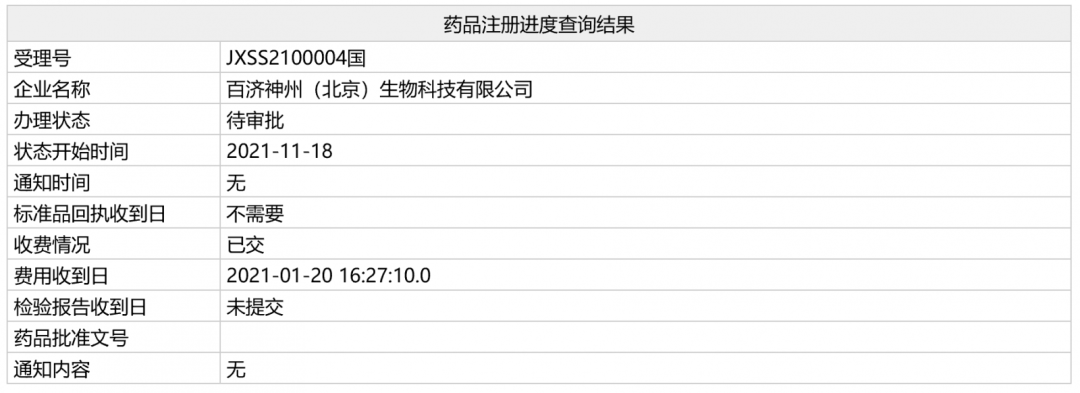
日前,百济神州从EUSA Pharma引进的司妥昔单抗在国内的上市申请(相关受理号为JXSS2100004/5)在NMPA的状态变更为“待审批”,预计近期有望获批,用于治疗人类免疫缺陷病毒(HIV)阴性和人类疱疹病毒8(HHV-8)阴性的多中心卡斯特曼病(多中心Castleman病)成年患者。
Castleman病是一种罕见、危及生命的衰竭性淋巴组织增生疾病,其特征是淋巴结肿大和受累淋巴结组织特有的组织病理学表现。根据淋巴结分布与器官受累部位,Castleman病分为单中心Castleman病和多中心Castleman病。其中单中心Castleman病仅累及单个淋巴结区域,全身症状反应较轻,预后较好,而多中心Castleman病累及多个淋巴结区域,多有全身症状,预后较差。
根据人类疱疹病毒-8(HHV-8)的感染状态,多中心Castleman病又进一步分为 HHV-8 阳性多中心Castleman病和 HHV-8 阴性多中心Castleman病。HHV-8 阴性多中心Castleman病,又叫特发性多中心型Castleman病,占多中心Castleman病的33%-58%。
Castleman病发病机制复杂,可能与多种过程有关,但引发的系统症状和病理改变通常由IL-6细胞因子风暴驱动。IL-6是一种强效的促炎细胞因子,在免疫调节、造血、炎症中起着重要作用。当IL-6过度增加,可以引起淋巴结肿大、贫血、低蛋白血症和全身水肿等一系列Castleman病的系统症状。
司妥昔单抗(Siltuximab)是一种抗 IL-6 的人鼠嵌合免疫球蛋白 G1κ型单抗,最初由强生研发,后授权给EUSA Pharma公司。2014年4月,该药被FDA批准用于用于治疗HIV阴性和HHV-8阴性的多中心Castleman病,商品名为Sylvant。2018年,该药被NCCN指南和Castleman病协作网(CDCN)指南推荐为特发性多中心型CD(iMCD)的一线治疗药物。截至目前,Sylvant已在全球40多个国家和地区获批上市。
2020年1月,百济神州与 EUSA Pharma达成合作,获得后者孤儿药Sylvant(司妥昔单抗)及Qarziba (达妥昔单抗β)在大中华地区的独家开发和商业化权益。达妥昔单抗β是一款GD2单抗,今年8月在国内被批准用于治疗高危神经母细胞瘤,具体适应症为:1) 治疗≥12月龄的高危神经母细胞瘤患者,这些患者既往接受过诱导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗;2) 治疗伴或不伴有残留病灶的复发性或难治性神经母细胞瘤。
在国内,司妥昔单抗被纳入CDE发布的《第一批临床急需境外新药》名单。今年1月,该药在国内递交的上市申请获CDE受理,同时被纳入优先审评程序。如今不到一年,该药在国内的上市申请就将进入行政审批,可见我国药品审批速度已经明显提高。若顺利获批,司妥昔单抗将成为国内首款且唯一一款获批治疗HIV阴性和HHV-8阴性的多中心型Castleman病的药物,同时也将成为国内获批的首款IL-6靶向单抗。
此外,除了司妥昔单抗,北京伟德杰生物科技有限公司的「重组人源化抗白介素-6受体单克隆抗体注射液」也被开发用于治疗HIV阴性和HHV-8阴性的特发性多中心型Castleman病(iMCD)。
“药渡”公众号所转载文章来源于其他公众号平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。

 药选址
药选址