皮肤恶性黑色素瘤是最具侵袭性和侵袭性的皮肤癌,也是导致大多数皮肤癌患者死亡的重要原因。目前的治疗近十年来,靶向PD1-PDL1的免疫检查点抑制剂、小分子BRAF和MEK抑制剂以及包括这些药物类别的联合方案彻底改变了恶性黑色素瘤的治疗。
恶性黑色素瘤患者常规检测BRAFV600激活突变,因为其在约40-50%的患者中表达。3种BRAF/MEK抑制剂联合治疗获批用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤患者——维罗非尼+cobimetinib(Zelboraf+Cotellic;Roche/Genentech/Chugai)、达拉非尼+曲美替尼(Tafinlar+Mekinist;Novartis)和encorafenib+binimetinib(Braftovi+Mektovi;Pfizer)——并且优先处方于单药BRAF抑制剂。达拉非尼+曲美替尼也获批用于淋巴结受累的BRAFV600突变阳性患者(局部晚期或III期疾病)完全切除后的辅助治疗;它是唯一获批作为辅助治疗的BRAF/MEK抑制剂组合。
PD1抑制剂nivolumab(Opdivo;百时美施贵宝)和pembrolizumab(Keytruda;默沙东)获批用于不可切除转移性疾病和淋巴结受累并接受完全切除患者的辅助治疗。FDA于2021年12月进一步扩大了pembrolizumab的适应症,纳入了完全切除的IIB–C期疾病复发高危患者;nivolumab正在一项正在进行的III期试验中以相同的背景进行评估。
PD1抑制剂nivolumab和CTLA4抑制剂ipilimumab(Yervoy;Bristol Myers Squibb)的双重免疫检查点阻断也被批准用于治疗不可切除或转移性疾病。
2022年3月,FDA批准了靶向LAG3和PD1的新型免疫检查点抑制剂组合。Opdualag(百时美施贵宝)是nivolumab和LAG3抑制剂relatlimab的首创、固定剂量复方制剂,用于治疗不可切除的转移性恶性黑色素瘤。在其III期试验(RELATIVITY-047)中,与nivolumab单药治疗相比,联合治疗使中位无进展生存期(PFS)延长了一倍以上,并显示出与nivolumab相似的安全性特征。Opdualag也正在评估作为III–IV期疾病完全切除后的辅助治疗(RELATIVITY-098)。
包含PDL1抑制剂阿特珠单抗(Tecentriq;Roche/Genentech/Chugai)、维罗非尼和考比替尼的三联方案为晚期BRAFV600突变阳性状态患者提供了一种替代一线治疗。尽管三联疗法的中位PFS和缓解持续时间长于双联BRAF/MEK疗法,但缺乏成熟的OS数据,且毒性更高。另一个由PD1(pembrolizumab)和BRAF/MEK抑制剂(encorafenib和binimetinib)组成的三联药物正在III期STARBOARD试验中作为一线晚期疾病治疗进行评估。
Talimogene laherparepvec(Imlygic;Amgen)是一种溶瘤病毒病灶内局部治疗,显示具有持久的抗肿瘤活性。已获批用于治疗初次手术后疾病复发的不可切除皮肤、皮下和淋巴结病变患者。其使用仅限于可触及注射病灶的患者。
最新治疗进展
恶性黑色素瘤产品线主要由涉及既定治疗(如PD1抑制剂)和新型治疗的组合方法组成(表1)。

乐伐替尼(Lenvima;卫材)是多种酪氨酸激酶的抑制剂。正在一项III期试验(LEAP-003)中研究其与派姆单抗联合给药作为不可切除或转移性疾病的一线治疗。在抗PD1/PDL1治疗后疾病进展的患者中评估了乐伐替尼+派姆单抗,LEAP-004 II期试验的中位OS达到14个月。
口服I类组蛋白去乙酰化酶(HDAC)抑制剂,HBI-8000(Hiyasta;HUYABIO)联合纳武利尤单抗治疗未接受过免疫检查点抑制的晚期恶性黑色素瘤患者正在进行III期临床试验。HBI-8000于2021年末在日本获批用于外周T细胞淋巴瘤。
同样在III期临床研究中的有两种病灶内治疗。第一种是toll样受体9(TLR9)激动剂vidutolimod(Checkmate Pharmaceuticals),以生物病毒样颗粒递送,可激活先天性免疫系统。目前正在研究其联合纳武利尤单抗作为晚期疾病的一线治疗(CMP-001-011),并获得FDA的快速通道审评资格。第二种是daromun(Nidlegy,Philogen),一种双重免疫细胞因子组合,包括L19-IL2(darleukin)和L19-TNF(fibromum),靶向纤连蛋白的EDB结构域。Daromun作为IIIB–C期疾病的新辅助治疗正在研究中。
治疗性疫苗正在进行恶性黑色素瘤的临床试验,所有这些疫苗均正在与PD1抑制剂联合使用进行评价。最先进的是IO102-IO103(IO Biotech),一种基于肽的疫苗,旨在靶向吲哚胺2,3-双加氧酶(IDO)和PDL1。在一项III期试验(IOB-013/KN-D18)中,IO102-IO103加派姆单抗作为既往未经治疗的不可切除或转移性疾病的一线疗法正在进行测试。其他治疗性疫苗以mRNA为基础,正处于II期试验阶段。BNT111(BioNTech)由一组固定的4种mRNA编码的肿瘤相关抗原组成;目前正在与cemiplimab(Libtayo;Sanofi/Regeneron)联合评价其治疗PD1复发或难治性不可切除或转移性疾病。BioNTech(与Genentech合作)还有另一种基于mRNA的恶性黑色素瘤候选疫苗BNT122(autogene cevumeran),一种新抗原和患者特异性疗法。Moderna和Merck&Co.还在与派姆单抗联合研发一种基于新抗原特异性mRNA的个体化疫苗(mRNA-4157)。
过继性细胞治疗正处于不可切除或转移性恶性黑色素瘤的早期临床开发阶段。Lifileucel(Iovance Biotherapeutics)和ITIL-168(Instil Bio)是自体(即患者来源)肿瘤浸润性淋巴细胞(TIL)细胞疗法,正在多队列II期试验中进行研究。Lifileucel正在进行两项试验;一项在PD1治疗患者中进行的试验具有潜在的注册授权队列(C-144-01),另一项在PD1初治患者中进行的试验包括与派姆单抗联合用药的评价(IOV-COM-202)。根据C-144-01试验的数据,Lifileucel获得了FDA的再生医学先进疗法认定。ITIL-168作为单药治疗PD1治疗患者(DELTA-1)的评价正在进行中,FDA授予其孤儿药资格。
诺华正在开发自己的靶向PD1和LAG3、spartalizumab加LAG525的联合治疗。在一项称为PLATforM的II期试验中,该组合正在评估用于既往治疗的不可切除或转移性疾病。
Tebentafusp(Kimmtrak;Immunocore)是一种靶向gp100并与CD3抗体片段融合的双特异性可溶性高亲和力T细胞受体(TCR)。它正在与阿斯利康的PDL1抑制剂(durvalumab,Imfinzi)和/或CTLA4抑制剂(tremelimumab)联合用于恶性黑色素瘤的Ib/II期试验。Tebentafusp成为2022年1月第一个获得FDA批准的TCR疗法,用于葡萄膜黑色素瘤。
商业市场分析
恶性黑色素瘤疗法的销售额在2021年销售总额为47亿美元,大部分(72%)由免疫检查点抑制剂持有:纳武单抗(14亿美元)、派姆单抗(13亿美元)和易普利姆玛(7.3亿美元)。预计2030年恶性黑色素瘤市场将每年增加5%,达到72亿美元,这是由于获批疗法的增多,包括适应症拓展和新疗法批准(图1)。
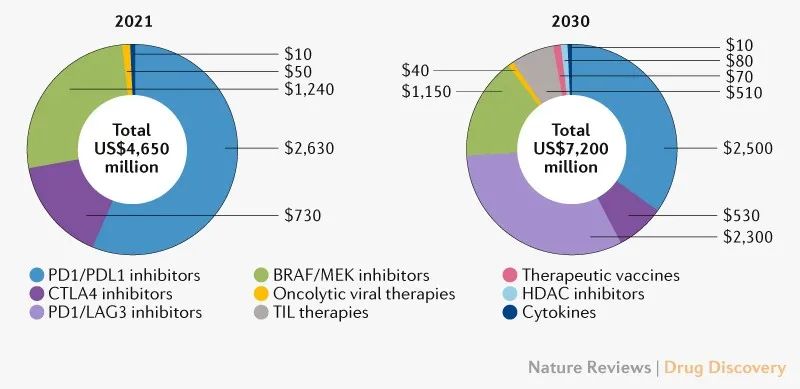
图1按药物类别分类的皮肤恶性黑素瘤关键疗法的市场销售额
检查点抑制剂有望在2021-2030年预测期内继续占主导地位,在2030年占据总市场份额的74%。最近获批的抗LAG3/PD1复方制剂Opdualag预计将成为最畅销的疗法(23亿美元),其次是派姆单抗(13亿美元)和纳武单抗(12亿美元)。尽管尚无Opdualag的长期OS数据,但其与nivolumab + 易普利姆玛相当的疗效(在PFS方面),加上其更有利的副作用特征,预期销售额会逐渐升高。
在2021-2030年期间,恶性黑色素瘤市场将越来越拥挤,预计到2030年将占有~58%的份额(42亿美元)。BRAF/MEK抑制剂组合预计占总市场的15%;预计encorafenib联合binimetinib是2030年商业上最成功的BRAF/MEK方案(7.06亿美元)。由于其高毒性、成本和与其他联合治疗的竞争,预期整合PD1/PDL1和BRAF/MEK抑制剂的三重联合治疗很难获得份额。2021-2030年期间其他值得注意的市场进入者包括首创的TIL疗法lifileucel,预计2030年将产生5.09亿美元。HDAC抑制剂HBI-8000和基于肽的疫苗IO102-IO103预计会产生较小的市场影响。
参考文献:




 个人中心
个人中心
 我是园区
我是园区






