
▌摘要
佐剂作为疫苗成分之一,可显著增强免疫反应的强度、广度和持久性。在20世纪20年代被引入之后,
铝佐剂
在接下来的70年里一直是唯一获准用于人类使用的佐剂。直到20世纪90年代,才有多种佐剂
(MF59、AS01、AS03、AS04、CpG等)
被纳入许可疫苗,但这些佐剂作用的分子机制尚不完全清楚。目前国内只有一款铝佐剂可用,大部分疫苗企业只能靠与GSK等企业合作来获得佐剂,某种程度上受制于人,这会影响疫苗的供应及生产成本控制。
换句话说,中国疫苗行业面临着被佐剂“卡脖子”的挑战
。本文回顾了佐剂发展历史,讨论了目前佐剂应用及进展,特别是在新型冠状病毒疫苗中的应用,佐剂分类,还讨论了佐剂分子机制以及最近新出现的概念。
佐剂(adjuvant)的概念是在20世纪初提出的,当时传统疫苗无法对纯化的白喉和破伤风类毒素产生有效的免疫反应。佐剂有诸多优点,如减少免疫针次、减少抗原用量、增强免疫反应等。佐剂的成分经历了从天然成分到人工合成化合物的转变过程,
1926年铝佐剂作用的发现是一个里程碑
,70多年来,不溶性铝盐一直是许可产品中唯一的佐剂,如乙肝、白喉、破伤风和百日咳疫苗或人乳头瘤病毒疫苗,佐剂发展历程见图1。
1997年MF59作为佐剂的三价流感疫苗Fluad在欧洲获批
,是继铝佐剂后第一个被列入人用新型疫苗的佐剂,是疫苗佐剂历史上又一个重大里程碑。迄今为止,获得许可的人类疫苗中使用的佐剂还包括AS01、AS03、AS04、CpG等。
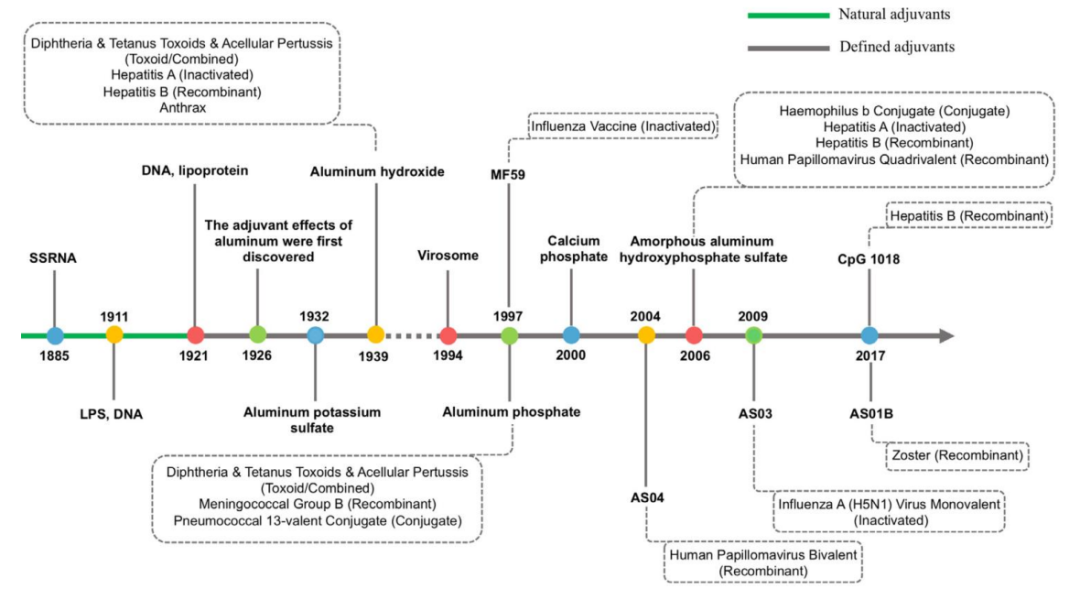
新疫苗佐剂的传统开发被描述为医学史上最慢的过程之一。在20世纪90年代末,水包油乳剂佐剂
MF59
首次包含在欧洲一种被称为Fluad的许可产品中,Fluad是一种针对季节性流感的三价灭活疫苗,许可用于65岁以上的成年人。
在此后的20年中,其他四种佐剂已包含在其他产品中:
AS01
(如用于带状疱疹疫苗Shingrix和疟疾疫苗Mosquirix)、
AS04
(如用于乙肝疫苗Fendrix和人乳头瘤疫苗Cervarix),
AS03
(如用于大流行性流感疫苗Pandemix和Arepanrix)和
CpG
(如用于乙型肝炎疫苗Heplisav-B)。值得注意的是在新型冠状病毒疫苗的开发中也广泛使用到佐剂,见表1。
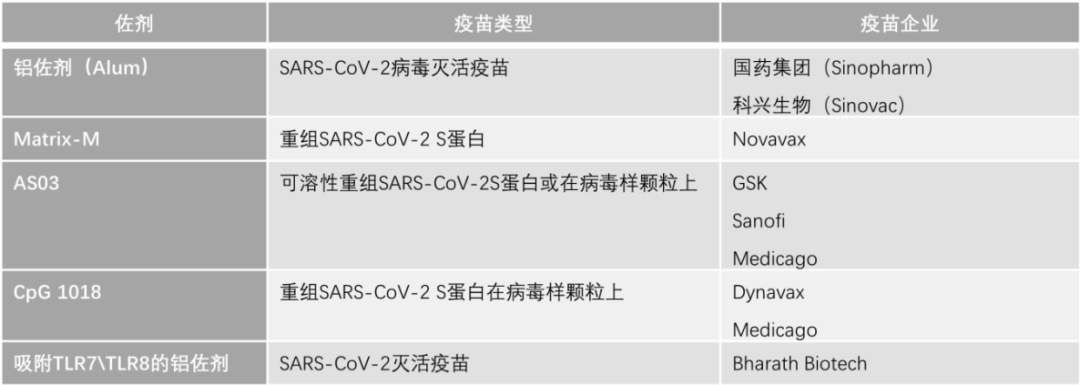
国内方面,目前,由于各种原因新型佐剂并未在我国获得批准,铝佐剂仍是我国唯一批准使用的疫苗佐剂。但是最近中科院过程工程研究所马光辉团队联合中科院微生物研究所严景华团队以及中科院北京生命科学研究院戴连攀团队,
利用自主创新的颗粒化乳液技术构建了用铝佐剂凝胶颗粒稳定的Pickering乳液(颗粒化乳液),并在COVID-19重组疫苗中取得了显著优于商品化铝佐剂的免疫应答效果
。
相关研究成果发表在《先进材料》(Advanced Materials)刊物上。
颗粒化乳液用于疫苗递送(兼具佐剂功能)是模拟病原体的仿生设计,对提升抗原的体液和细胞免疫效果具有通用性
,见图2。并在2014年申请国内外专利,并已获得了中国发明专利授权(ZL201410272743.4)和日本专利授权(JP6434995)。
图2. 颗粒铝通过Pickering乳剂作为增强型COVID-19疫苗佐剂(Peng,2020)
(a:颗粒化乳液技术策略示意图;b:颗粒化乳液扫描电镜图;c:共聚焦图像:d:抗原吸附颗粒化乳液示意图;e和f:在指定温度下储存0和120天后颗粒化乳液外观)
铝盐主要包括磷酸铝、氢氧化铝和硫酸铝钾三种。目前常用的铝佐剂为氢氧化铝和磷酸铝。氢氧化铝佐剂实际上是Al(OH)3的不完全脱水产物,即纤维状结晶形态的偏氢氧化铝AlO(OH);磷酸铝佐剂是羟基磷酸铝复合物,为无定形结构,见图3。
铝佐剂仍然是人用疫苗中广泛使用的佐剂,不夸张的说,如果没有铝盐佐剂,可能市场上50%的疫苗就不存在
。然而,铝佐剂也存在缺点,铝佐剂对增加血清抗体通常有效,但会引起注射部位反应,诱导细胞免疫的能力较弱,在一定程度上限制了它的应用,并且对某些疫苗(例如流感),铝盐佐剂的效果不显著。
图3. 铝佐剂电子透射显微镜照片(Hem, 1995)
MF59佐剂是一种水包油乳剂,成分包含4%~5%角鲨烯、0.5%Tween 80、0.5%三油酸聚山梨酯(Span 85),见图4。将Span85分散在含有角鲨烯和Tween80的缓冲液中,高速搅拌至乳状。之后将乳剂反复用微射流机流射以形成o/w乳剂的微粒(160nm),再过滤除菌。MF59乳剂制备后可保持稳定性达3年以上。
MF59佐剂可诱导产生比铝佐剂更强的体液免疫反应
。流感疫苗的动物实验结果显示,MF59佐剂的流感疫苗诱导的抗体免疫反应比铝佐剂高100倍,同时也能诱导产生一定的Th1型细胞免疫反应。有大量的数据证明,
使用MF59佐剂的流感疫苗对老人和幼儿的保护性比不含佐剂的疫苗要高出一倍
。对MF59及其疫苗进行的GLP毒理学研究表明,MF59及其疫苗没有潜在的系统毒性。MF59佐剂Chiron公司的研究人员在20世纪90年代开发的,被诺华公司于2006年收购。2014年诺华又把含MF59的流感疫苗卖给了澳大利亚的Sequirs公司。
皂苷作为疫苗佐剂已经使用了很长时间,成分QS-21是一种从Quillaja saponaria Molina树的树皮提取物中纯化的三萜糖苷,目前作用机制不详。在人体和动物实验中,QS-21能促进抗原特异性抗体CD4+和CD8+辅助性T细胞的反应。
AS01是GSK经过20多年努力开发出的佐剂一种基于脂质体并含有两种免疫刺激剂的复合佐剂,成功的应用有疟疾和老年带状疱疹疫苗。GSK研发的重组带状疱疹疫苗Shingrix(CHO细胞)使用了AS01B作为佐剂,用于50 岁及以上成人,预防带状疱疹及带状疱疹后神经痛,临床数据显示其针对50岁 以上人群的保护效力超过90%。含AS01的疟疾疫苗在非洲推广使用,其保护性并不很理想。但老年带状疱疹疫苗的有效性比弱毒苗有明显的优势。2017年10月Shingrix在美国批准上市,上市后快速放量,
2020年其销售额高达25.7亿 美元
。2019年5月在中国获批,2020年6月正式上市,成为国内首个上市的带状疱疹疫苗。
免疫系统对抗外来病原生物入侵,首先需要识别并区分外来抗原和自身抗原。这一识别过程由先天免疫细胞,即树突细胞或巨噬细胞通过
模式识别受体(PRR)
完成。PRR有多种受体家族,包括
Toll样受体(TLRs)、NOD样受体(NLRs)、C型凝集素受体(CLRs)、RIG-I样受体(RLRs)和细胞质DNA/RNA受体
等。这些受体能够识别脂多糖(LPS)、脂蛋白、鞭毛蛋白以及一些特定的核苷酸序列。一旦模式识别受体 受到上述物质刺激,就会启动炎症相关基因的表达,激活免疫系统以应对感染。
细胞因子是机体的免疫系统在受到抗原和各种免疫佐剂激活后,产生应答性的一类免疫调节物质,具有明显的免疫佐剂效应。IL是由白细胞分泌的细胞因子,佐剂效应比较明显的是IL-2和IL-12,目前主要在DNA疫苗中做临床前研究。IL-2是DC分泌的细胞因子,可作用于T、B淋巴和NK等多种细胞,引发Th1型应答并激活效应T淋巴细胞,选择性增强Th1型细胞分化增殖,诱导和释放包 括IFN-γ在内的各种细胞因子,产生特异性细胞免疫应答。有关研究表明使用高剂量的IL-2有相当大的毒性,易引起血管渗漏,因此,IL-2作为佐剂的安全性还需进一步研究。
尽管有的佐剂(包括铝佐剂、MF59和AS系列佐剂)被广泛使用,但这些佐剂在人体中实际起作用的分子机制尚不完全清楚。20世纪90年代末,人们发现,
Toll样受体(TLR)
等受体的激活会导致树突状细胞(DC)的激活,从而刺激抗原特异性T细胞和B细胞反应。Toll样受体通常在树突状细胞(DC)上表达,并在微生物中感知高度保守的
病原体相关分子模式(PAMP)
。这些发现为1989年Charlie Janeway提出的主要概念提供了有力的实验证据:先天免疫系统通过模式识别受体(PRR,如TLR)感知微生物,模式识别受体识别PAMP并导致先天免疫细胞的激活和随后的适应性免疫反应。
(佐剂形成抗原库,并在注射部位招募免疫细胞;它们可以在抗原内吞之前或期间激活招募的APC的PRR,之后抗原被处理并呈现给T细胞,导致细胞免疫反应和/或体液免疫反应)
随后的研究发现,在
TLR、C型凝集素(CLR)
、
胞浆模式识别受体(Cytosolic PRRs)
、
DNA传感器(如STING蛋白)和NOD样受体(NLR)也发现了激活炎性体的药物,并显示其影响适应性免疫,靶向这些受体的分子也被作为潜在的疫苗佐剂进行研究,见图6。
图6. 佐剂的分子靶点与机制(a:TLR;b:CLR;c:CLR)
然而,在过去十年中取得的两项重大进展开始对佐剂的作用机制产生更深入的见解,并正在振兴佐剂的发现和开发过程,这是几十年来的现状。
首先,免疫学家关于如何刺激免疫系统的观点已经超越了Janeway最初提出的PAMPs模式识别范式。因此,有证据表明,DC和先天免疫系统的其他细胞不仅可以通过PRRs的病原体感应激活,
还可以通过组织损伤激活,从而导致损伤相关分子模式(DAMP)的释放,以及通过细胞死亡,以及其他应激信号,如氨基酸饥饿(通过应激和营养感应途径)
。这些刺激中的许多都被证明能诱导适应性免疫,从而支持Polly Matzinger在1994年提出的
“危险模型”的概念
。
其次,利用系统生物学方法探索疫苗的先天性和适应性免疫反应,并定义驱动人类疫苗的先天性和适应性免疫反应的分子网络,开始产生关于免疫反应如何启动和控制的基本新机制见解。
这种“系统疫苗学”方法现在越来越多地被用于评估人类对疫苗接种的免疫反应
,识别可以预测疫苗效力的分子特征,并获得机理见解。
理想的佐剂应具有广谱的安全性、易于生产和使用,并能有效激活体液和细胞免疫反应而无不良反应。需要控制和改善佐剂的理化性质,优化生产工艺。深入研究佐剂的作用机制,全面了解其对免疫系统的影响,进一步为安全有效地使用佐剂以增强疫苗的免疫效果铺平道路。
特别是国内疫苗行业面临着被佐剂“卡脖子”的挑战,对于我国疫苗行业来说,开发安全有效的新型疫苗佐剂、拓宽佐剂在疫苗中的应用范围任重而道远
。

参考文献
[1]Pulendran B, S Arunachalam P, O'Hagan DT. Emerging concepts in the science of vaccine adjuvants. Nat Rev Drug Discov. 2021;20(6):454-475. doi:10.1038/s41573-021-00163-y
[2]Peng S, Cao F, Xia Y, et al. Particulate Alum via Pickering Emulsion for an Enhanced COVID-19 Vaccine Adjuvant. Adv Mater. 2020;32(40):e2004210. doi:10.1002/adma.202004210.
[3]Del Giudice G, Rappuoli R, Didierlaurent AM. Correlates of adjuvanticity: A review on adjuvants in licensed vaccines. Semin Immunol. 2018;39:14-21. doi:10.1016/j.smim.2018.05.001
[4]Hem SL, White JL. Structure and properties of aluminum-containing adjuvants. Pharm Biotechnol. 1995;6:249-276. doi:10.1007/978-1-4615-1823-5_9
[5]Goullé JP, Grangeot-Keros L. Aluminum and vaccines: Current state of knowledge. Med Mal Infect. 2020;50(1):16-21. doi:10.1016/j.medmal.2019.09.012
[6]微信公众号(生物制品圈):疫苗佐剂的研究进展;https://mp.weixin.qq.com/s/jy8BDMe9cR4Zymqh9T_Gxg [2017-02-11发布,2022-06-10引用]
[7]Bastola R, Noh G, Keum T, et al. Vaccine adjuvants: smart components to boost the immune system. Arch Pharm Res. 2017;40(11):1238-1248. doi:10.1007/s12272-017-0969-z
[8]O'Hagan DT, Ott GS, De Gregorio E, Seubert A. The mechanism of action of MF59 - an innately attractive adjuvant formulation [published correction appears in Vaccine. 2013 Apr 3;31(14):1877]. Vaccine. 2012;30(29):4341-4348. doi:10.1016/j.vaccine.2011.09.061
识别微信二维码,添加生物制品圈小编,符合条件者即可加入微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。















 个人中心
个人中心
 我是园区
我是园区





