替尔泊肽之后,礼来三靶点降糖药来了!国内临床试验已启动
收藏
关键词:
临床药礼来靶点
资讯来源:Insight数据库 + 订阅账号
发布时间:
2022-09-27
9 月 27 日,据 Insight 数据库显示,礼来 GIPR/GLP-1R/GCGR 三重激动剂 LY3437943 国内首次公示临床试验。
来自:Insight 数据库网页版 (http://db.dxy.cn/v5/home/)
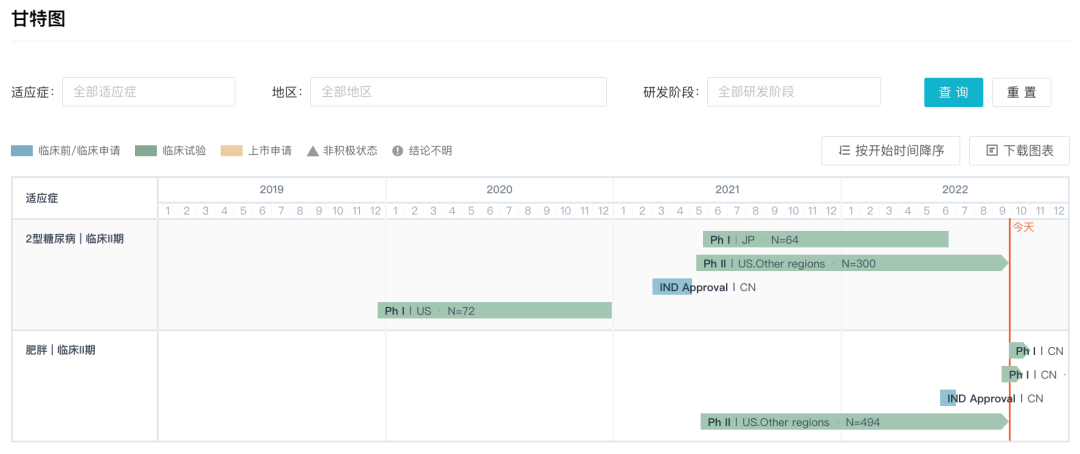
当前 LY3437943 正在中国 BMI 超重或肥胖受试者中开展一项 I 期临床研究(登记号:CTR20222436),目标人组人数为 32 人,尚未开始招募。不过,礼来已于 9 月 16 日在 ClinicalTrials.gov 上登记了该项研究(登记号:NCT05548231)。
LY3437943 是礼来在研的一款 GIPR/GLP-1R/GCGR 三重激动剂,对葡萄糖依赖性促胰岛素多肽(GIP)、胰高血糖素样多肽(GLP-1)、胰高血糖素受体具有强大的活性。
此前披露的临床前数据表明,在肥胖糖尿病小鼠模型中,LY3437943 表现出比 GLP-1RA 更强的血糖控制和体重减轻作用。
在 2021 年第 81 届美国糖尿病协会(ADA)上,礼来披露了 LY3437943 在健康受试者中首次进行人体给药研究的数据,研究显示单次给药后 LY3437943 的平均终末半衰期为134~165h,支持每周1次给药;同时,观察到其安全性、耐药性特征与其他肠促胰素药物类似。
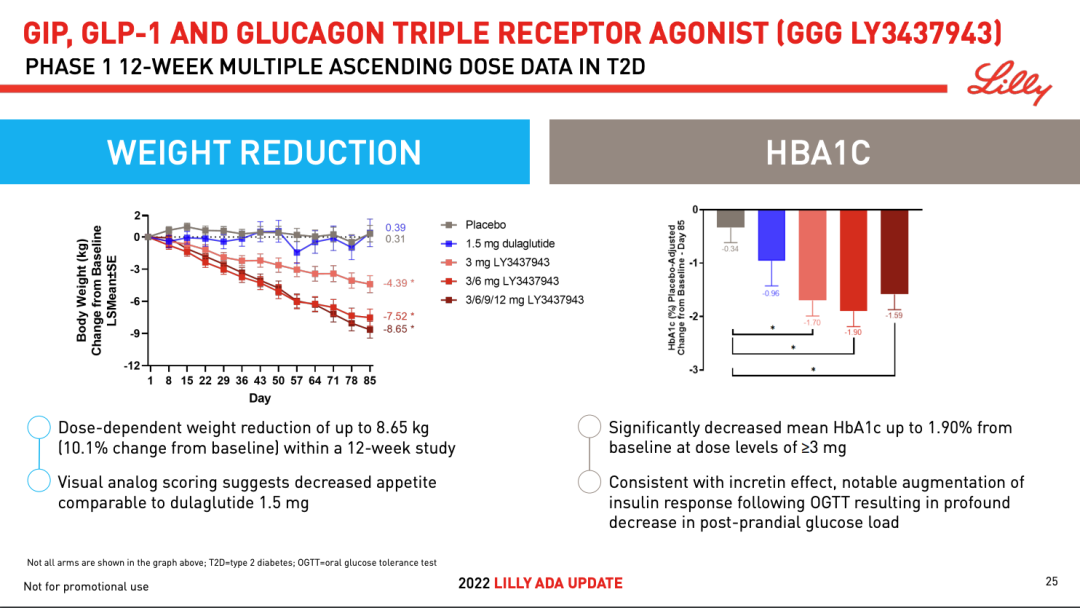
而在今年 EASD 会上,有学者进一步披露了概念验证研究数据。这是一项随机、双盲、安慰剂对照的 1 期临床研究,旨在评估 2 型糖尿病患者 LY3437943 多次递增剂量给药的安全性和耐受性。
该研究共纳入 72 名患者,并被随机分配至 5 个剂量的 LY3437943 组、安慰剂组以及 dulaglutide 组(1.5mg)。给药 12 周后,监测患者糖化血红蛋白(HbA1c)和体重的变化。
结果显示:在疗效方面,除了初始队列外,LY3437943 组可观察到体重呈剂量依赖性下降,最高可达 8.96kg;从 HBA1C 水平来看,在 ≥3mg 剂量水平下,平均 HBA1C 水平较基线显著降低至 1.90%。在安全性方面,最常见的治疗性 AE 是胃肠道反应。
该研究表明, LY3437943 在 2 型糖尿病患者中表现出降血糖和减重的潜力。
据 Insight 数据库显示,LY3437943 已于 2021 年 5 月在美国等地开展针对 2 型糖尿病患者的 II 期临床研究(登记号:NCT04867785);同时开展的还有针对肥胖/超重人群的 II 期临床试验(登记号:NCT04881760),目前已完成所有受试者招募工作,该研究预计于今年 11 月完成,期待数据读出。
在国内,LY3437943 于 2021 年 3 月首次临床,同年 5 月首次获批临床,并于今日首次公示临床试验。
通过开发同时激动多个与代谢相关的靶点来治疗代谢性疾病是目前新药研发最新趋势,当前国内外各大药企已经将降糖药研发的重点聚焦于此。礼来更是该方向的领路人,近 5 年内已有 5 款多靶点激动剂进入临床阶段。
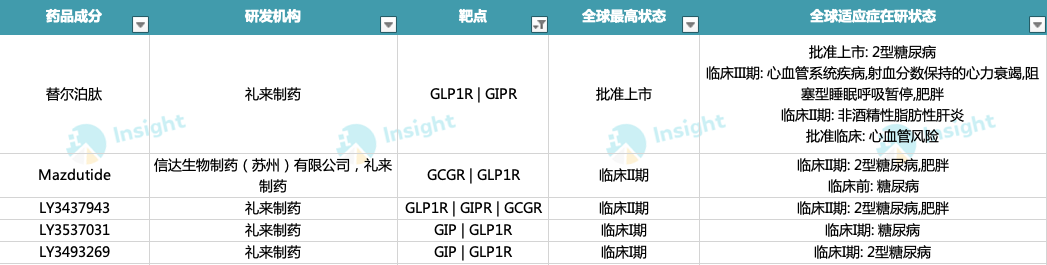
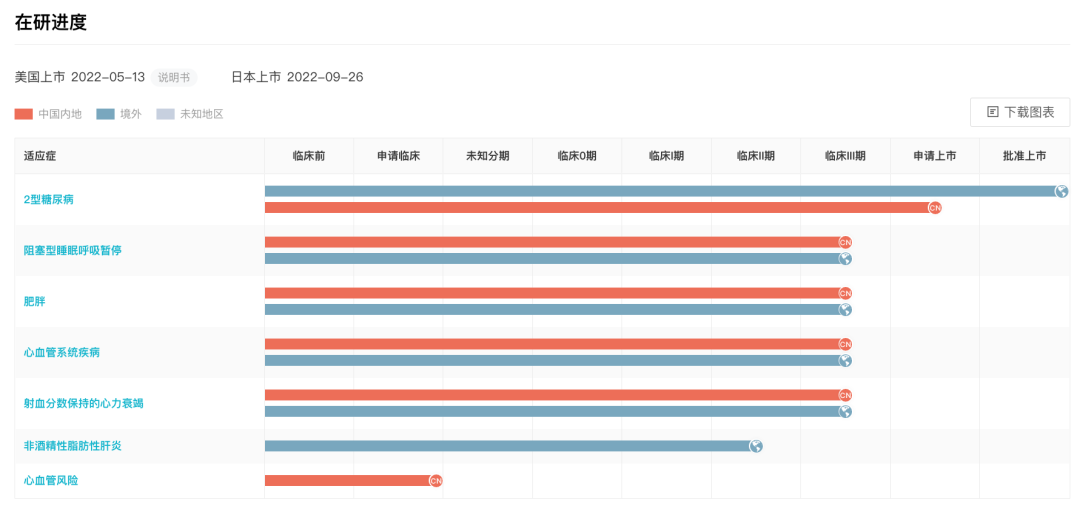
礼来 5 款 GLP-1R 多靶点激动剂进入临床阶段
其布局的 GIP/GLP-1R 双重激动剂每周给药一次的替尔泊肽注射液(Tirzepatide)已获批上市,成为首款治疗 2 型糖尿病的 GLP-1R 双靶点降糖药。
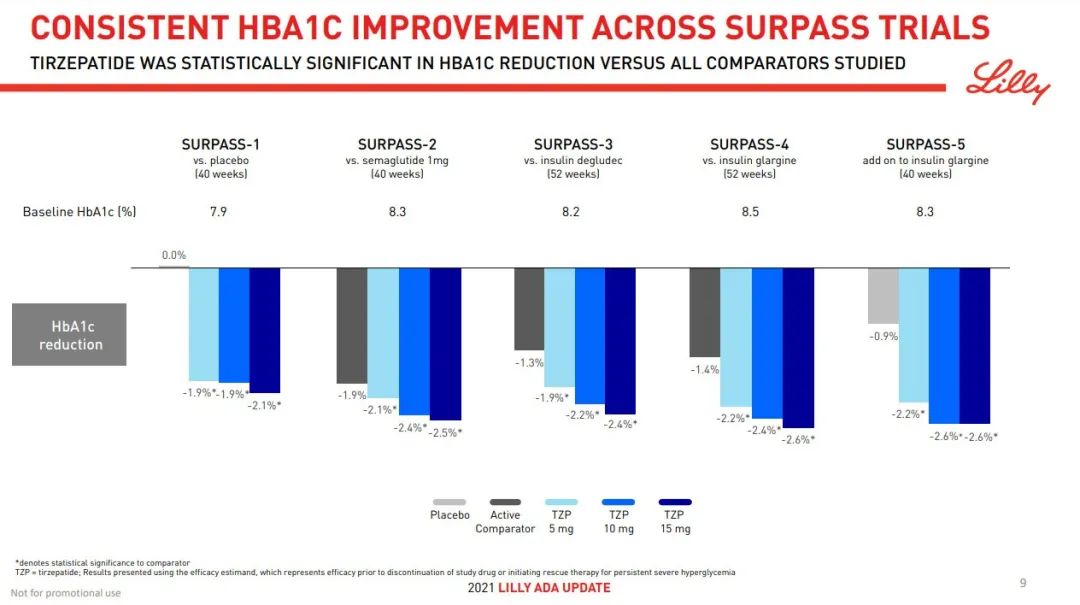
该产品曾在大型 III 期临床中头对头击败司美格鲁肽,表现十分亮眼。该项 SURPASS-2 (登记号:NCT03987919)研究比较了 Tirzepatide 5 mg (N=470)、10 mg (N=469) 和 15 mg (N=469) 与司美格鲁肽 1 mg (N= 468) 的降糖效果。
结果显示,相较于基线 A1C 水平(8.3%),Tirzepatide 使受试者 A1C 平均降低了 2.0%、2.2% 和 2.3%,而司美格鲁肽平均降低 1.9%;减重方面,相较于 207 磅的基线体重,
Tirzepatide 使受试者平均减重 17 磅、21 磅和 25 磅,而司美格鲁肽为 13 磅。
挑战司美格鲁肽成功意味着新一轮革命即将掀起,双靶点激动剂类降糖药即将成为后续降糖领域的主要竞争者。
针对 2 型糖尿病,Tirzepatide 于今年 5 月获 FDA 批准上市,并刚于本月在国内申报上市。
目前 Tirzepatide 仍在针对代谢类疾病进行全面布局和快速推进,包括肥胖症、NASH、HFpEF、肾病(CKD)、睡眠呼吸暂停综合征(OSA)等适应症。
除 Tirzepatide 外,礼来另有 2 款 GIP/GLP-1R 双重激动剂 LY3537031、LY3493269 目前处于 I 期临床阶段。
值得一提的是,礼来对于 GLP-1R/GCGR 双重激动剂也有布局,其与信达共同开发和商业化的 Mazdutide 目前已处于 II 期临床阶段。
Mazdutide 是一款胃泌酸调节素创新化合物(OXM3),在同类产品中具有最优潜力。作为一种与哺乳动物胃泌酸调节素类似的长效合成肽,Mazdutide 利用脂肪酰基侧链延长作用时间,允许每周给药一次。
Mazdutide 的作用被认为是通过 GLP-1R 和 GCGR 的结合和激活介导的,与 OXM 具有相似作用机制,因此预计其可以改善葡萄糖耐量并减轻体重。除了 GLP-1R 激动剂具有的促进胰岛素分泌、降低血糖和减轻体重等作用外,Mazdutide 还可能通过 GCGR 的激活具有增加能量消耗和改善肝脏脂肪代谢等效应。
今年 6 月信达披露的数据表明 Mazdutide 在肥胖症领域有着巨大潜力。
这是一项随机、双盲、安慰剂对照的 II 期临床研究(登记号:NCT04904913),旨在评估 Mazdutide(研发代号:IBI362)在中国超重或肥胖受试者中的有效性和安全性。主要研究终点为持续给药 24 周后体重相对基线的百分比变化。共 230 例受试者(92.7%)完成 24 周主要终点访视。
结果显示,研究达到主要临床终点和所有的关键次要临床终点,Mazdutide 各剂量在中国超重或肥胖受试者中展现出显著的减重疗效,且呈剂量依赖性。
同时,在此次 II 期研究中已经同步实现了自动注射器的应用,极大改善了研究受试者生活质量与依从性。
基于以上积极结果,信达表示,将于今年下半年开始积极推进 Mazdutide III 期临床研究的开展。
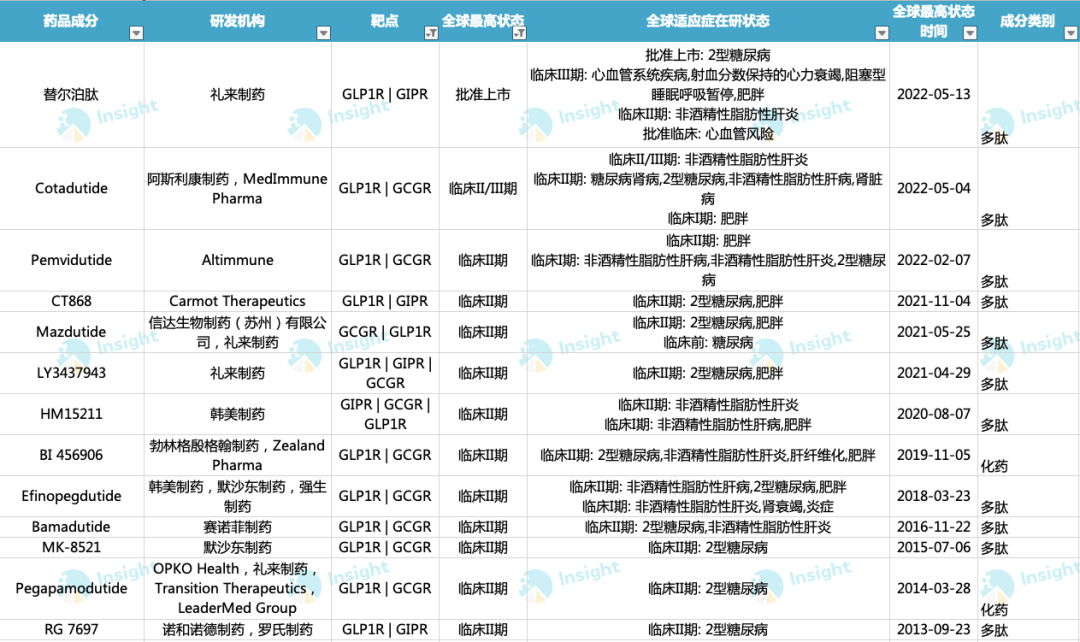
除礼来以外,阿斯利康、韩美制药、赛诺菲、诺和诺德等早已入局该领域。据 Insight 数据库显示,当前
全球共有 13 款 GLP-1R 多靶点激动剂进入 II 期临床及以上阶段
。
全球 GLP-1R 多靶点在研产品(II 期临床及以上阶段)
免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
免费试用 Insight 数据库






 药选址
药选址









