罗氏PD-L1第3项适应症在华获批!一线治疗NSCLC
收藏
关键词:
适应症治疗获批罗氏
资讯来源:中国医药创新促进会 + 订阅账号
发布时间:
2021-05-01
本文转载自医药魔方
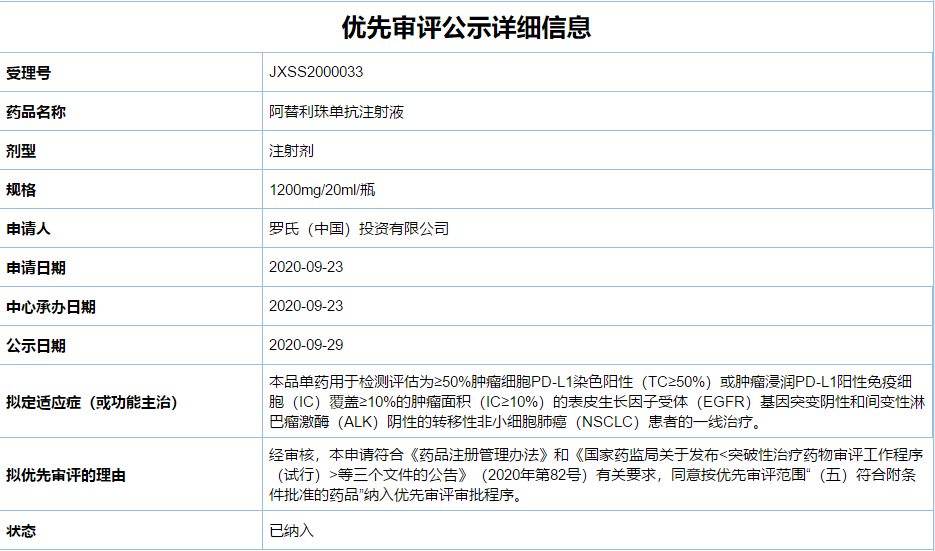
4月29日,国家药监局官网显示,罗氏PD-L1阿替利珠单抗(Tecentriq)新适应症上市申请(受理号:JXSS2000033)已获得NMPA批准,用于检测评估为≥50%肿瘤细胞PD-L1染色阳性(TC≥50%)或肿瘤浸润PD-L1阳性免疫细胞(IC)覆盖≥10%的肿瘤面积(IC≥10%)的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非小细胞肺癌(NSCLC)患者的一线治疗。这是阿替利珠单抗在国内获批的第3个适应症。

代号为IMpower110的全球多中心、随机对照、III期临床试验对比了阿替利珠单抗单药 vs. 标准含铂双药化疗一线治疗PD-L1高表达,ALK和EGFR阴性NSCLC患者的疗效和安全性。
2019年ESMO大会公布了该研究主要分析结果,在PD-L1高表达(TC3/IC3-WT)患者中,阿替利珠单抗组与化疗组中位总生存期(OS)分别为20.2个月和13.1个月(HR=0.59,95%CI:0.40-0.89,P=0.0106),延长7.1个月,患者死亡风险降低了41%。
2020年WCLC会议上IMpower110研究更新结果显示,在PD-L1高表达ALK和EGFR阴性NSCLC患者中,阿替利珠单抗组与化疗组中位无进展生存期(PFS)分别为8.2个月和5.0个月(HR=0.59,95%CI:0.43-0.81),客观缓解率(ORR)分别为40.2%和28.6%,中位缓解持续时间(DoR)分别为38.9个月和8.3个月。
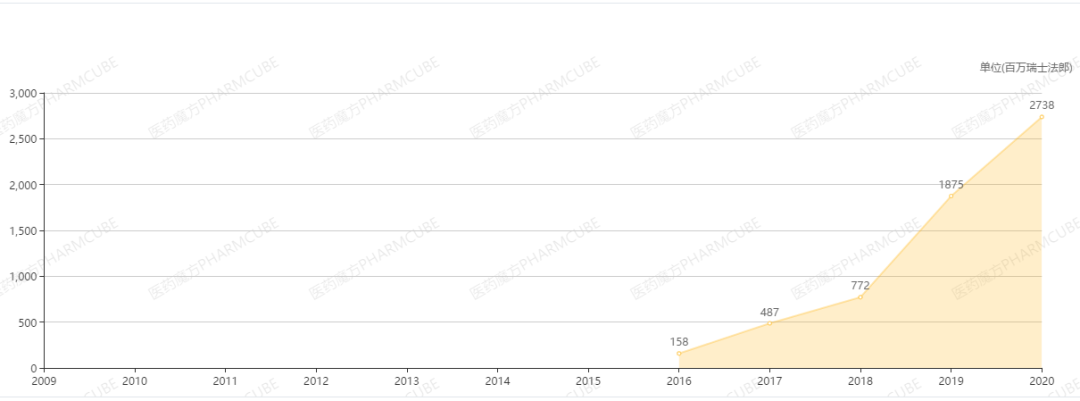
阿替利珠单抗于2019年2月首次在中国获批,联合化疗一线治疗广泛期小细胞肺癌。2020年10月,第2项适应症获批,联合贝伐珠单抗一线治疗肝癌,目前最新中标价格为32800元/瓶,尚未进入医保目录。根据罗氏财报,阿替利珠单抗2020年全球销售额为27.38亿瑞士法郎。今年第1季度销售额同比增长26%,达到7.75亿瑞士法郎。
医药魔方
罗氏于2020年9月23日向NMPA递交了该项适应症的上市申请并被CDE纳入了优先审评。
国内外已有多种PD-1/L1抑制剂获批一线治疗NSCLC适应症,但多数药物获批的适应症是联合化疗使用,仅有阿替利珠单抗、帕博利珠单抗和Cemiplimab三种药物获批单药治疗PD-L1高表达患者。其中,阿替利珠单抗是目前唯一获批用于该类患者的PD-L1抑制剂。




 药选址
药选址


