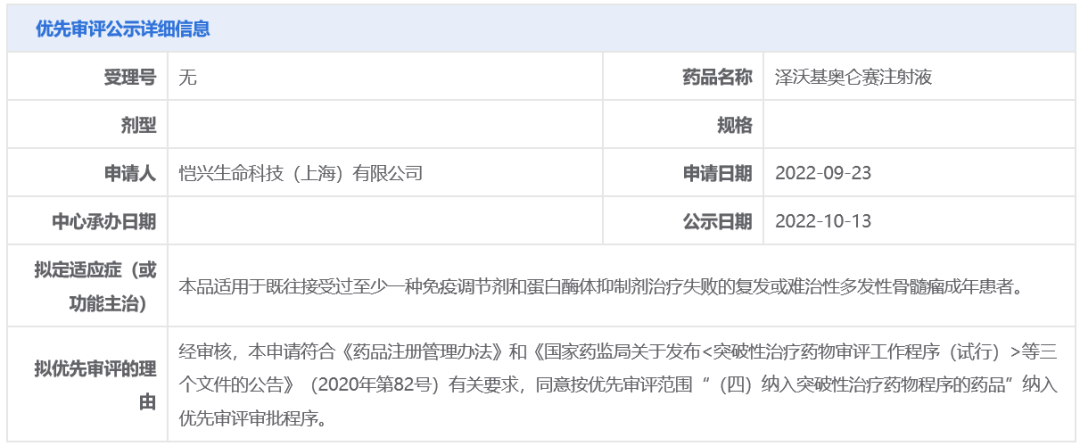
 中国国家药监局药品审评中心(
CDE
)官网公示,科济药业
BCMA CAR-T
产品泽沃基奥仑赛注射液(
CT053
)拟纳入优先审评,拟定适应症为:适用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的
复发或难治性多发性骨髓瘤(R/R MM)
成年患者。此前,该药治疗多发性骨髓瘤的适应症
已被CDE纳入突破性治疗品种
。
中国国家药监局药品审评中心(
CDE
)官网公示,科济药业
BCMA CAR-T
产品泽沃基奥仑赛注射液(
CT053
)拟纳入优先审评,拟定适应症为:适用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的
复发或难治性多发性骨髓瘤(R/R MM)
成年患者。此前,该药治疗多发性骨髓瘤的适应症
已被CDE纳入突破性治疗品种
。
CT053(又称zevor-cel)是由科济药业自主研发的创新疗法,采用全人抗体靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)修饰的T细胞,主要目标适应症为R/R MM。公开资料显示,该产品融合了具有较低免疫原性和较高稳定性的全人抗BCMA特异性单链抗体的CAR结构,在没有肿瘤相关靶点的情况下,可降低CAR-T细胞的自动激活,克服了T细胞耗竭的问题。
根据科济药业公布的2022年中期业绩,该公司已经完成中国关键性2期试验(LUMMICAR STUDY 1)的患者入组,并计划于2022年第三季度向中国国家药监局(NMPA)提交新药上市申请(NDA)。LUMMICAR-1研究是一项在复发和/或难治多发性骨髓瘤中国患者中开展的1/2期研究,主要研究终点是评估CT053的安全性和耐受性并确定2期推荐剂量,次要研究终点是进一步评估有效性、安全性和药代动力学。
根据2021年11月在美国血液学会(ASH)年会上公布的结果,LUMMICAR-1研究1期共14例复发/难治多发性骨髓瘤受试者接受CT053治疗,截至2021年7月8日,中位随访时间达13.6个月。整体耐受性良好,未报告剂量限制性毒性(DLT)或死亡。未观察到≥3级细胞因子释放综合征(CRS)或神经毒性。14例受试者的总缓解率(ORR)达到100%,其中78.6%(11/14)为微小残留病变(MRD)阴性严格意义的完全缓解(sCR)。12个月无进展生存(PFS)率为85.7%。在未合并髓外病变(EMD)的12例受试者中,完全缓解率达到91.7%(11/12),12个月PFS率达到100%。
在海外,CT053曾获美国FDA授予再生医学先进疗法(RMAT)和孤儿药资格,获欧洲药品管理局(EMA)授予优先药物资格(PRIME)和孤儿药资格。目前,科济药业正在北美进行关键性2期试验(LUMMICAR STUDY 2),并计划于2023年向FDA提交生物药物上市许可申请(BLA)。该公司还计划进行额外临床试验,以开发CT053作为多发性骨髓瘤的早期治疗方法。
多发性骨髓瘤是一种无法治愈的血癌,起源于骨髓,以浆细胞增殖过度为特征。尽管患者经过治疗可能会有一些缓解,但不幸的是,患者很可能会复发。接受标准疗法治疗后复发的患者会面临预后不佳,治疗手段受限的问题。
希望科济药业CT053在临床研究和注册申报中进展顺利,早日为多发性骨髓瘤患者带来新的治疗选择。
参考资料:
[1] 中国药物临床试验登记与信息公示平台. Retrieved Oct 12 , 2022. From http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
[2]ASH报告 | 科济药业CT053 BCMA CAR-T研究成果在2021 ASH年会最新披露. Retrieved Dec 13 , 2021. From https://mp.weixin.qq.com/s/97c-400G2vc76galL45TlA

 中国国家药监局药品审评中心(
CDE
)官网公示,科济药业
BCMA CAR-T
产品泽沃基奥仑赛注射液(
CT053
)拟纳入优先审评,拟定适应症为:适用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的
复发或难治性多发性骨髓瘤(R/R MM)
成年患者。此前,该药治疗多发性骨髓瘤的适应症
已被CDE纳入突破性治疗品种
。
中国国家药监局药品审评中心(
CDE
)官网公示,科济药业
BCMA CAR-T
产品泽沃基奥仑赛注射液(
CT053
)拟纳入优先审评,拟定适应症为:适用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的
复发或难治性多发性骨髓瘤(R/R MM)
成年患者。此前,该药治疗多发性骨髓瘤的适应症
已被CDE纳入突破性治疗品种
。





 个人中心
个人中心
 我是园区
我是园区




