
DNA甲基化是最早被发现、也是研究最深入的表观遗传调控机制之一。第一个被发现的5-甲基胞嘧啶(5mC)是研究最多的修饰碱基,它在从基因调控到正常发育的广泛生物过程中发挥着重要作用,被认为是第五个碱基。5-羟甲基胞嘧啶(5hmC)是由5mC经过TET家族酶氧化而来,在神经元细胞含量较高,被认为是第六碱基。
DNA甲基化修饰在维持正常细胞的功能、雌性个体X染色体失活、寄生DNA序列的抑制、基因组结构稳定、遗传印记、胚胎发育、及肿瘤和疾病的发生、发展紧密相关,具有至关重要的作用。
5mC可以导致基因沉默或基因表达水平降低,因此,肿瘤抑癌基因的过甲基化或原癌基因的低甲基化在多种肿瘤中被发现。而5hmC作为去甲基化过程的第一步,则会导致基因激活或基因表达水平增高,研究表明DNA的5hmC在多种肿瘤中有明显降低。因此,分析基因组的5mC和5hmC水平具有重要的临床意义。
WGBS(Whole-genome bisulfite sequencing)被视为甲基化测序的“金标准”,主要检测5mC和5hmC两种修饰形式。在此基础上衍生出了的一些方法用来区分5mC和5hmC,比如氧化亚硫酸氢盐测序(oxBS-seq)被用于5mC特异性测序,以及TET辅助的重亚硫酸盐测序(TAB-seq)特异性检测5hmC。
近年来,基于酶法转化的甲基化测序技术不断涌现出来,APOBEC偶联甲基化表观测序 (ACE-seq)可以特异性检测5hmC,以及酶法甲基化测序(EM-seq)可同时检测5mC和5hmC。TAPS技术一改之前将未发生甲基化修饰的C转化未U的方法,创新性的实现了正向检测甲基化位点的测序技术,其衍生技术TAPSβ及CAPS,亦可实现5mC和5hmC的区分,具有巨大的潜力。
一、氧化亚硫酸氢盐测序oxBS-seq
该技术在将传统的BS-Seq技术与化学氧化相结合,先利用高钌酸钾KRuO4将DNA上的5hmC氧化成5fC,再用重亚硫酸盐处理,5fC和没有任何修饰的C就被转化成U,而5mC则不会被转化,仍然保持为C。如此则可以特异性的检测5mC,BS-Seq和oxBS-Seq联合测序也可实现对5hmC单碱基分辨率的检测。
其技术原理示意图如下(图1):
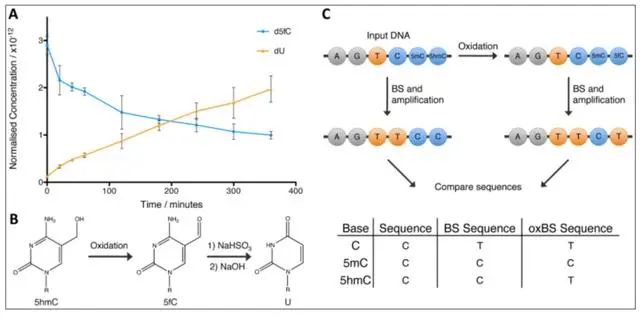
图1.oxBS-seq 5mC单碱基分辨率测序(Booth, M. J. et al.2012, Science)
二、TET辅助的重亚硫酸盐测序(TAB-seq)
用糖基把羟甲基化的C给保护起来,然后用TET蛋白(Ten-eleven translocation methylcytosine dioxygenase 1),把甲基化的C转化成羟基化的C,进一步将羟甲基化的C转化成甲酰化的C和羧基化的C。甲酰化的C和羧基化的C都可以被亚硫酸氢盐转化成U。而之前被糖基化保护起来的羟甲基化的C,是不会被TET蛋白转化成甲酰化的C或者羧基化的C的。在亚硫酸氢盐的处理过程中,它还保持是C。并且在之后的PCR扩增产物中,也表现为C。这样,就可以把羟甲基化的C和甲基化的C给区分开来,从而特异性的检测5hmC。
其技术原理示意图如图(图2):

图2.TAB-seq 5hmC单碱基分辨率测序 (Yu, M. et al. 2012, Cell)
三、APOBEC偶联甲基化测序(ACE-seq)
不同于传统的BS-Seq,该技术使用AID/APOBEC家族DNA脱氨酶APOBEC3A (A3A)代替化学脱氨,保证了DNA的完整性。首先,利用T4 β-葡糖基转移酶(βGT)将5hmC转化成5ghmC,5ghmC不会被A3A酶脱氨基,这样A3A能够特异地脱去C及5mC的氨基使其变为U,而5ghmC则因为不被该酶识别,测序时仍被检测为C。这样,可将5hmC与C及5mC区分开来,实现特异性检测5hmC。
该技术原理示意图如下(图3):
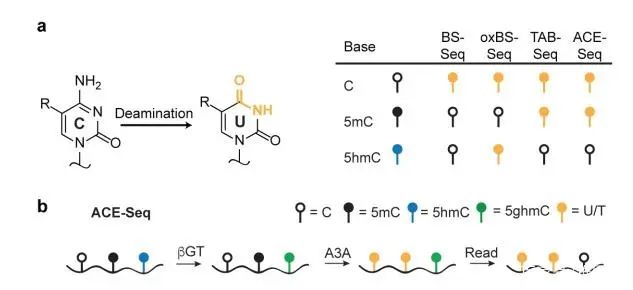
图3.ACE-seq 5hmC单碱基分辨率测序(Schutsky, E. K. et al. 2018, Nat. Biotechnol)
四、酶法甲基化测序(EM-seq)
全基因组重亚硫酸盐测序(WGBS)长期以来一直是甲基化图谱分析的金标准,但重亚硫酸盐的化学反应会破坏和降解DNA,导致DNA断裂和丢失。基于酶法的甲基化测序就克服了这个缺点。
Enzymatic Methyl-seq(EM-seq)通过酶法完成WGBS建库,其对DNA的酶处理分为两步:第一步使用TET2酶以及氧化增强剂将5mC和5hmC氧化成5caC,保护经过修饰的胞嘧啶;第二步利用脱氨酶APOBEC对胞嘧啶进行脱氨处理,此步骤不会对5caC造成影响,从而实现5mC和5hmC的检测。
其技术原理示意图如下(图4):
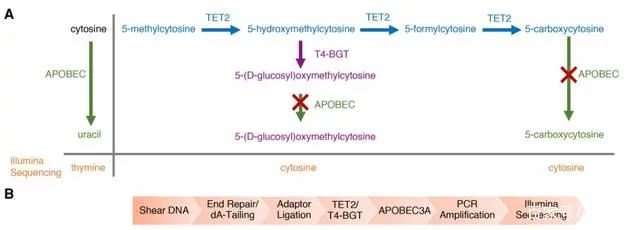
图4.EM-seq 单碱基分辨率测序(Vaisvila, R. et al.2020, bioRxiv)
五、TET辅助吡啶硼烷测序(TAPS)(TET-assisted pyridine borane sequencing)、TAPSβ及CAPS
在TAB-seq中讲到TET蛋白可以把甲基化的C转化成羟基化的C,进一步将羟甲基化的C转化成甲酰化的C和羧基化的C。TAPS技术发现5caC可以被吡啶硼烷及衍生物(Pyridine borane)还原为二氢尿嘧啶(dihydrouracil,DHU),而DHU在链扩增方面与自然的U碱基并没有差异,这样经过PCR扩增DHU可以转化为T,从而到达不用亚硫酸盐处理将甲基化的C碱基转为T碱基的目的。TAPS得到的DNA文库复杂度高(仅把占比很小的甲基化C进行了改变,对DNA的天然序列改变很小,碱基平衡),避免了bisulfite法引起的DNA损伤及文库的不平衡,对Illumina测序仪更加友好,数据质量较高。
TAPS的衍生方法TAPSβ及CAPS可分别用于检测5mC和5hmC。TAPSβ也是用糖基化酶把羟甲基化的C给保护起来,使其免受TET氧化。再使用TET酶将甲基化的C转化羟甲基化的C在转化成甲酰化的C和羧基化的C。5caC则可在吡啶硼烷还原为二氢尿嘧啶,而被保护起来的羟甲基化的C则不变。经过后续步骤测序则可特异性的区分5mC。CAPS技术仍利用利用了oxBS-seq中高钌酸钾KRuO4将DNA上的5hmC氧化成5fC,经吡啶硼烷的衍生物(pic-borane)5fC还原成二氢尿嘧啶,从而实现特异性的检测5hmC。
该系列技术原理示意图如下(图5):
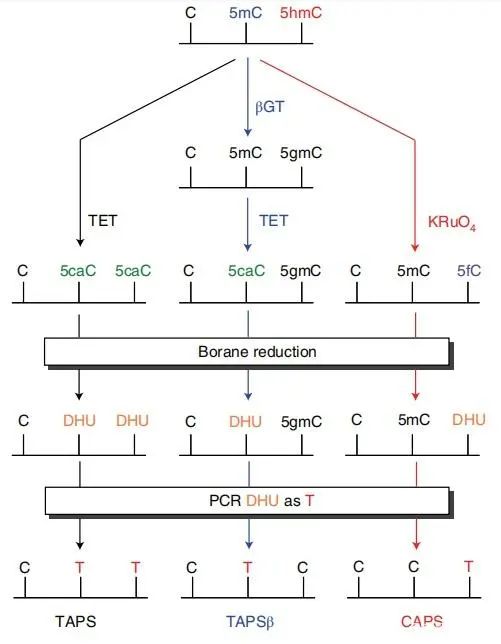
图5.TAPS、TAPSβ、CAPS 单碱基分辨率测序(Liu, Y. et al.2021, Nat Commun)
以上就是几种对于5mC和5hmC测序方法,随着高通量测序技术的发展以及新技术的不断涌现,甲基化检测技术将在癌症早期诊断及筛查领域有更广阔的发展前景。
参考文献:
[1] Booth, M. J. et al. Quantitative sequencing of 5-methylcytosine and 5-hydroxymethylcytosine at single-base resolution. Science 336, 934–937 (2012).
[2] Yu, M. et al. Base-resolution analysis of 5-hydroxymethylcytosine in the mammalian genome. Cell 149, 1368–1380 (2012).
[3] Schutsky, E. K. et al. Nondestructive, base-resolution sequencing of 5-hydroxymethylcytosine using a DNA deaminase. Nat. Biotechnol. 36,1083–1090 (2018).
[4] Vaisvila, R. et al. EM-seq: detection of DNA methylation at single base resolution from picograms of DNA. Preprint at bioRxiv https://doi.org/ 10.1101/2019.12.20.884692 (2020).
[5] Liu, Y., Hu, Z., Cheng, J. et al. Subtraction-free and bisulfite-free specific sequencing of 5-methylcytosine and its oxidized derivatives atbase resolution. Nat Commun 27;12(1):618(2021).
目前已有500+行业精英加入基因俱乐部
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区





