
7月21日,亚盛医药宣布,MDM2-p53抑制剂APG-115获得FDA孤儿药资格认定,用于治疗IIB-IV期黑色素瘤。这是APG-115继胃癌、急性髓系白血病、软组织肉瘤、视网膜母细胞瘤后,获得的第五项FDA授予的孤儿药资格认定。
黑色素瘤是一种潜在致命的皮肤恶性肿瘤,可发生于正常皮肤,也可由色素痣恶变形成。它在全世界的发病率持续上升,美国患黑色素瘤的终生风险为1/63。数据显示,2019年美国新增黑色素瘤患者约96,480名,因黑色素瘤死亡的患者约7230名。而我国恶性黑色素瘤的发病率不高,但有逐渐增高的趋势。
自2011年以来,黑色素瘤的临床治疗取得了前所未有的进展。靶向疗法和免疫疗法等新治疗方式的出现,极大的延长了患者生存周期并改善了患者生存质量。免疫疗法中,以抗CTLA-4单抗、抗PD-1单抗和抗PD-L1单抗为代表的免疫检查点抑制剂(ICI)的临床研究最成熟、应用最广泛。尽管如此,相当数量的患者最终会出现ICI耐药,而迄今仍没有任何治疗方式获批用于治疗ICI耐药的黑色素瘤患者。
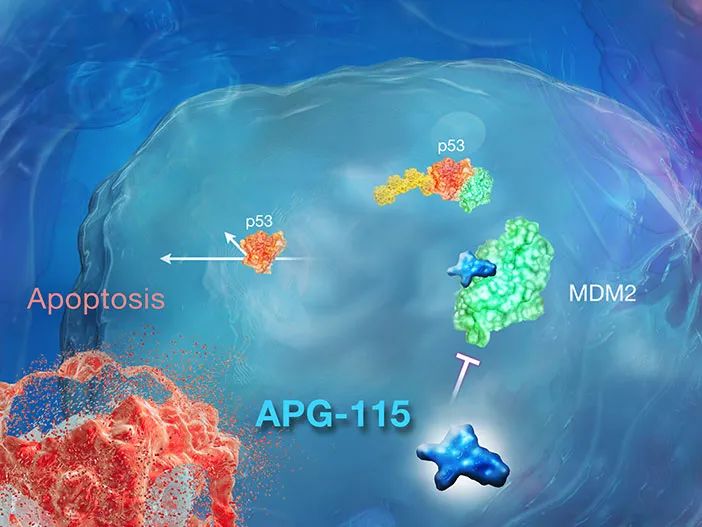
APG-115是一种口服、高选择性的MDM2-p53抑制剂。MDM2是一种E3泛素连接酶,可以诱导p53泛素化,然后经蛋白酶体降解。APG-115对MDM2具有高度结合亲和力,通过阻断MDM2-p53相互作用从而恢复p53肿瘤抑制活性。临床前研究发现,它与PD-1抑制剂联合使用时,可以触发适应性抗肿瘤免疫以增强抗肿瘤活性。
APG-115联合帕博利珠单抗的II期临床数据,显示了良好的抗肿瘤活性和安全性。在APG-115联合帕博利珠单抗治疗PD-1/PD-L1抑制剂耐药的黑色素瘤队列中,有一例患者获得完全缓解(CR),该队列的客观缓解率(ORR)达24.1%,疾病控制率(DCR)达 55.2%。
亚盛医药首席医学官翟一帆博士表示:“针对黑色素瘤的治疗目前仍存在较大的、尚未满足的临床需求,因此,APG-115获得此项孤儿药认定意义非凡。此次APG-115斩获的第五项孤儿药认定和亚盛医药斩获的第12项孤儿药认定,进一步垒实了我们‘创中国药企孤儿药认证历来之最’的领先地位,也体现了公司全球化创新能力与水平。未来我们将继续坚守‘解决中国乃至全球患者尚未满足的临床需求’的使命。希望在FDA孤儿药政策的推动下,包括APG-115在内的多个公司在研品种能进一步加快临床开发,早日获批,从而更快的造福更多患者。”

点亮“在看”,好文相伴



 个人中心
个人中心
 我是园区
我是园区




