介绍
自然杀伤细胞是先天效应淋巴细胞,可介导针对应激细胞、恶性细胞和病毒感染细胞的有效免疫反应。与B和T 细胞相反,它们可以立即起作用,不需要任何启动或抗原呈递。NK细胞基本上通过两种不同的途径杀死靶细胞。胞吐途径涉及释放含有穿孔素和颗粒酶的细胞毒性颗粒以及促炎细胞因子(包括诱导靶细胞裂解的 IFNγ)的分泌。在这种情况下,NK 细胞的激活取决于不同种系编码的激活和抑制受体产生的信号之间的平衡。所有这些信号的总和然后诱导 NK 细胞激活或抑制。激活受体识别在受损和感染细胞(包括涂有 IgG 抗体的细胞)上发现的配体,而抑制性受体识别在健康细胞上发现的配体,包括 MHC-I 分子。第二种途径是通过靶细胞上的死亡受体与其 NK 细胞上的同源配体的相互作用介导的,导致靶细胞凋亡。靶细胞杀伤需要 NK 细胞和靶细胞之间的紧密接触,主要由整合素 LFA-1 及其相应的配体启动。然后形成的所谓的免疫突触 (IS) 确保了死亡诱导物质的定向释放,并促进了额外的细胞间相互作用。
NK 细胞能够浸润实体瘤,肿瘤块内的高密度NK细胞浸润已被证明与更好的患者预后有关。此外,通过控制血流中的循环肿瘤细胞,已知NK细胞可以防止转移的形成,其占所有癌症死亡的90%。这些功能使NK细胞成为癌症免疫治疗的主要候选者。
已经进行了几项研究来评估离体扩增NK细胞的潜在用途,比较自体和同种异体 NK 细胞。由于自身HLA分子的抑制以及NK细胞的扩增和功能有限,自体 NK 细胞的过继转移没有取得预期的成功,这可能是由于在大多数情况下对患者进行了大量的预处理。由于这些限制,研究的重点转移到同种异体 NK 细胞,这在临床试验中证明是有希望的。由于肿瘤细胞已经进化出几种不同的策略来逃避NK细胞介导的杀伤,例如释放配体以激活受体或上调MHC-I,NK细胞受体表达的离体操作是克服免疫反应的有前途的工具抑制。
NK细胞(天然或转基因 CAR-NK 细胞)的临床应用需要旨在产生大量高纯度 NK 细胞的培养过程。适当扩增过程的优化取决于多种因素,包括起始材料、细胞因子等添加剂以及培养系统本身。同时,还描述了各种不同且极其异质的膨胀过程。免疫细胞扩增技术包括简单培养瓶、多层培养瓶(如 Millicell、Millipore 或 BD Multi-flask 等)、微载体技术以及特殊培养系统(如 G-Rex、WAVE 型生物反应器) , Zellwerk的Z®RP Cell Breeder、Miltenyi的CliniMACS Prodigy®、TERUMO Quantum 系统)(Pörtner 等,2017、2019)。所有设备材料均为一次性产品,在处理和无菌方面具有优势。
大多数这些技术的主要缺点是它们大多以批处理模式运行。因此,培养基中的营养物质和代谢物浓度在培养过程中不断变化,导致收获的免疫细胞制剂中存在的表型组成发生变化。这些不一致的培养条件可能导致许多临床试验的报告不一致。为了确保用于细胞疗法的免疫细胞生产的可重复性,必须控制、评估、记录和验证工艺条件。因此,免疫细胞扩增过程中培养基中温度、pH 值和 pO2 的连续动态控制是必不可少的,因为这些参数会严重影响细胞行为。此外,作为底物和代谢物的先导物质的葡萄糖和乳酸浓度也应在加工过程中得到稳定控制。在这种情况下,灌注系统创造了一个均质的环境,并允许受控的动态介质和气体交换,从而通过灵活的过程控制实现高细胞密度。
本文开发并评估了一种用于扩增人类 NK 细胞的创新灌注过程。该过程基于 Zellwerk 的 Z®RP 平台和所属的曲流型生物反应器,为不同免疫细胞的大规模生产提供了复杂的功能,并允许在功能封闭的环境中进行细胞培养和分离。
Z®RP 系统的生物反应器可以在 GMP Breeder 中运行。该平台自动调节培养过程的关键参数(pH、pO2、培养基温度、培养基灌注、进料速度)。因此,灌注生物反应器过程保证了培养细胞的营养和气体的均匀供应。此外,不需要细胞的传代。专有软件允许自动记录和评估过程数据。细胞培养平台及其一次性生物反应器能够在 GMP 条件下生产大量个体免疫细胞制剂。

图 1. Zellwerk的 Z®RP 平台。(A) M型生物反应器50M;(B) GMP Z®RP Cell BREEDER配备M型生物反应器50M,适用于大量生产NK细胞/T细胞/肿瘤浸润淋巴细胞/间充质干细胞;
NK细胞扩增
在 Zellwerk GmbH 开发的专有培养过程中,CD3+ T 细胞耗尽的 PBMC 被分离和体外扩增。简而言之,从五个供体中获得用于研究目的的匿名血液产品(全血),与 RosetteSep™ 人CD3耗竭鸡尾酒混合并孵育30分钟。随后,在密度梯度离心中使用Lymphoprep分离PBMC。将获得的PBMC用 PBS 洗涤两次,然后如以下部分所述直接接种到生物反应器中。
根据我们的研究,我们使用了在 Z®RP GMP Breeder 培养平台中运行的 Z®RP 生物反应器 50M。如图 2 所示,生物反应器本身集成在循环回路中。在使用之前,灌注生物反应器50M涂有特定的专有活化混合物。在这些条件下,NK 细胞的生长通常会增强,细胞分裂会持续很长时间,并且与传统培养的NK细胞相比,收获的NK细胞显示出更高的细胞毒性。涂覆后,反应器最初填充35 ml α 培养基,并补充有葡萄糖 (2.5 g/L)、10% 人血清、L-谷氨酰胺、庆大霉素、1,000 IU/ml 人 IL-2作为专有的激活鸡尾酒。生物反应器接种了约70×106个细胞。为此,将细胞重新悬浮在9.5 ml培养基中,并通过注射器通过取样口注入生物反应器的前两排。2 小时后,当细胞沉降后,开启培养基循环和通气。
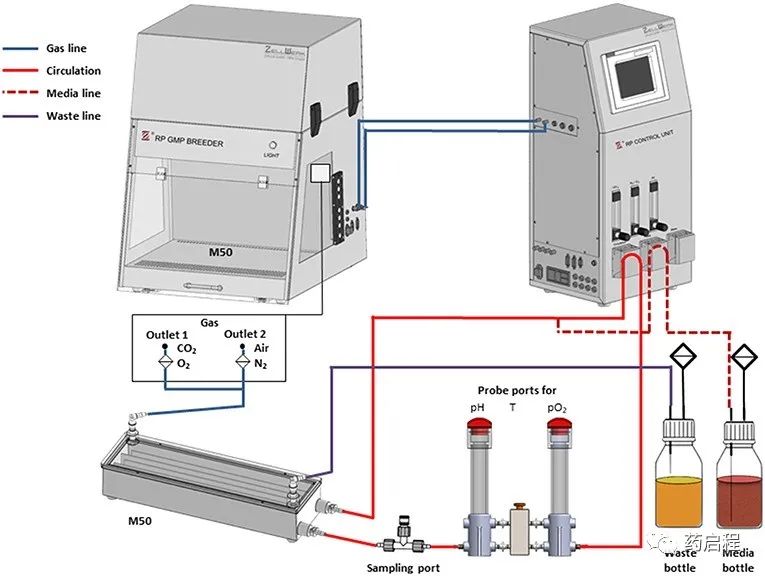
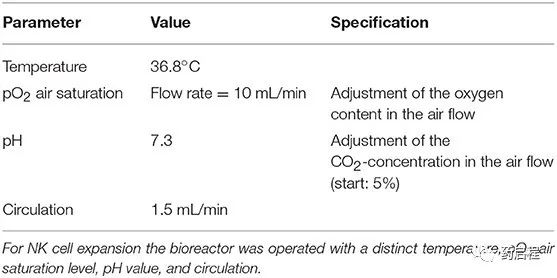
生物反应器操作的工艺参数列于表 1 中。在培养过程中,每个工作日通过注射器抽取 0.5 ml 培养基。这些样品中乳酸(数据未显示)和葡萄糖(比较图 3)的含量通过生化分析仪(YSI 2000 Select,YSI)测定。在第一阶段,生物反应器在没有培养基流入的情况下运行,让细胞开始生长,而葡萄糖浓度的降低被用作细胞生长的指标。当葡萄糖浓度达到~1 g/L 的目标值时,手动调整新鲜培养基的流入量(灌注率)以保持该值。细胞被扩增直到获得~1 × 109 的最终细胞数。在取样进行细胞计数之前,摇动生物反应器以悬浮细胞。在 12-22 天的时间内实现了所需的细胞数量。收获细胞,然后用干冰运送到汉堡-埃彭多夫大学医学中心,并在那里储存在液氮中,直到用于分析。用作起始材料的 PBMC 的数量和培养时间列于表 2。
试验结果
灌注培养
Z®RP 生物反应器 50M 内灌注培养的时间过程如图 3 所示。平均而言,葡萄糖浓度在约 10 天内降至所需的1 g/L水平。之后,目标浓度保持在± 20%的范围内(图 3 所示第10天后的标准偏差平均值)。细胞密度的指数增加反映在灌注速率的相应增加上。大标准偏差解释了不同供体初始细胞生长的巨大差异。
NK细胞纯度
由于 PBMC 作为NK细胞的来源,我们首先使用流式细胞术评估了所有五个供体样本中的NK细胞纯度(图 4)。在最初的步骤中,我们排除了死细胞和细胞双联体,然后鉴定了CD45+白细胞。在白细胞群中,我们区分了 CD56+ NK/NK-T细胞和非NK细胞。仔细观察CD3和CD19的非NK细胞部分表达,分别反映了 T 淋巴细胞和B淋巴细胞的存在。对 CD3 和 CD19 呈阴性的细胞进一步分析CD14表达以鉴定单核细胞。对于 NK/NK-T 细胞部分,CD3表达用于将CD56+CD3+ NK-T 细胞与 CD56+CD3-NK 细胞区分开来。在所有情况下,NK细胞纯度均达到 85% 以上,而供体1-3的细胞纯度比供体4-5高90%以上。在所有供者的细胞中,T细胞、B细胞和NK T细胞的频率低于2%。单核细胞代表NK细胞之后所有分析的细胞组分中的第二大细胞,例如,达到供体 5 中总细胞的 6% 以上(图 5)。
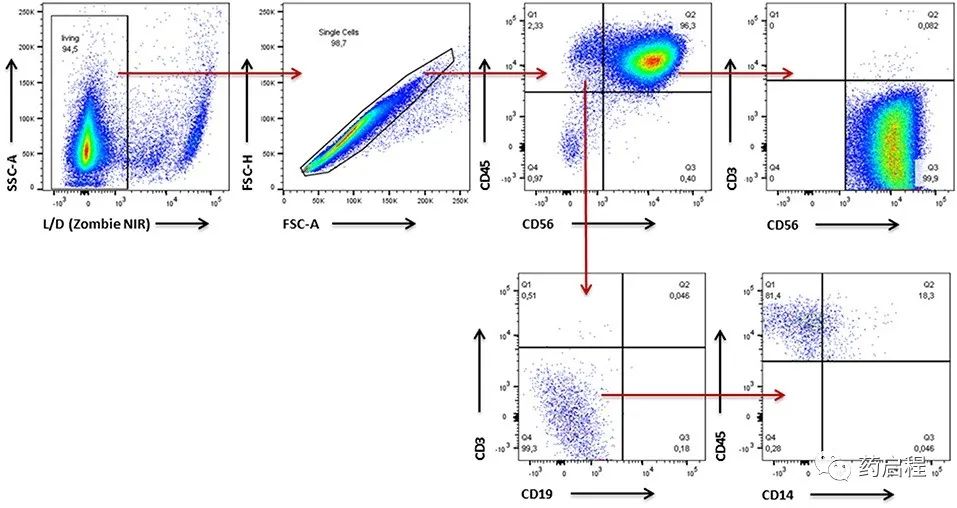
图 4. 分析 NK 细胞纯度和表面分子表达模式的门控策略。
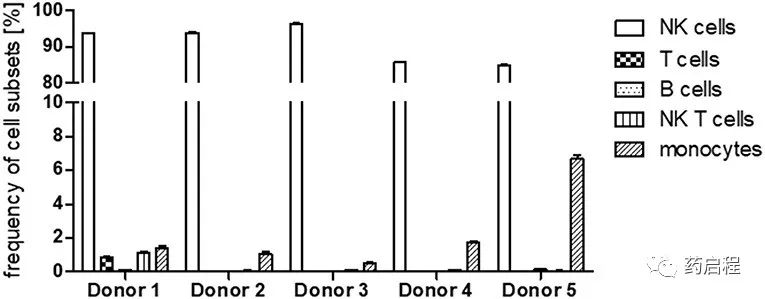
图 5. 扩增后细胞子集的频率。
趋化因子受体的表达
非炎症条件下的NK细胞组织分布以及它们向炎症和肿瘤部位的募集受多种不同趋化因子的调节。因此,NK细胞在其表面表达各种趋化因子受体。
趋化因子CXCL9和CXCL10及其受体CXCR3 对NK细胞的功效至关重要,因为它们会促使它们募集到实体瘤中。已显示淋巴细胞的高肿瘤浸润与多种不同癌症的延长生存期相关。CXCR3 表达可以在IL-2扩增的NK细胞上测量,并在IL-2再刺激的细胞上进行更高程度的测量(图 6A)。
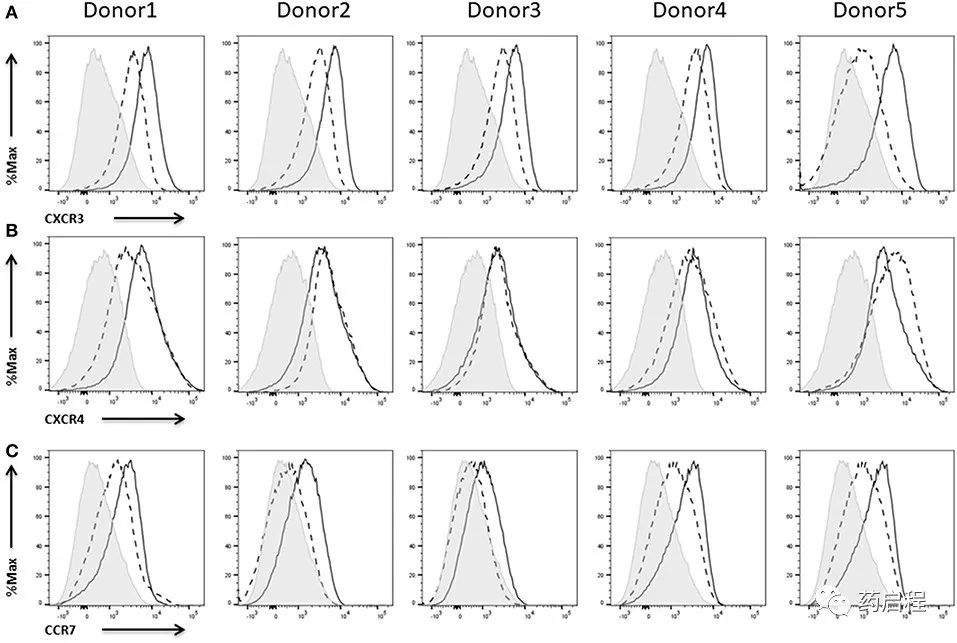
CXCR4/CXCL12轴已被描述为调节NK细胞在骨髓中的定位,并且似乎对于将NK细胞募集到神经母细胞瘤和多发性骨髓瘤的肿瘤部位很重要。我们已经可以测量新鲜解冻的 L-2扩增NK细胞上的CXCR4表达。用IL-2激活NK细胞仅对受体的表达产生轻微影响(图 6B)。
CCR7介导外周淋巴结等淋巴组织的归巢。因此,这种受体在 NK 细胞上的表达被认为是靶向淋巴结转移的优势。来自五个供体中的三个的 NK 细胞在IL-2扩增的NK细胞上显示出相当弱的CCR7表达,而IL-2再刺激诱导或增强了受体的表达(图 6C)。
细胞粘附分子的表达
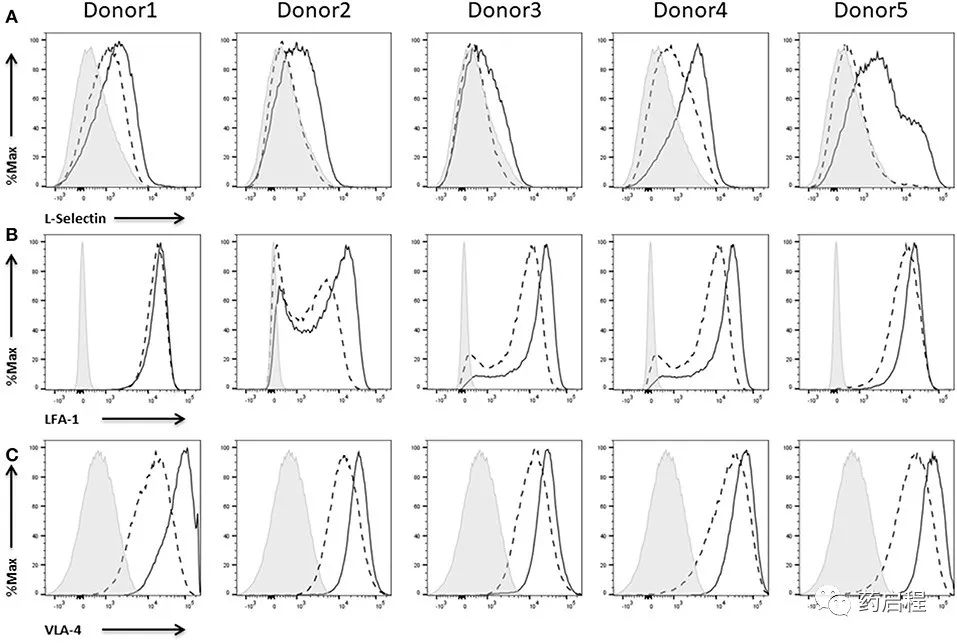
与其他白细胞一样,NK 细胞需要不同的粘附分子才能离开血流并进入外周组织。选择素结合碳水化合物参与白细胞和内皮之间的初始相互作用,导致白细胞在内皮上滚动。在这些选择素中,只有 L-选择素在白细胞表面表达,而 E-和 P-选择素存在于活化的内皮细胞上。此外,L-选择素对于淋巴细胞归巢至外周淋巴结至关重要。
白细胞对内皮的强粘附依赖于整联蛋白,主要是 LFA-1 和 VLA-4。在它们的高亲和力状态下,这些整合素分别结合它们的配体ICAM-1和VCAM-1,导致白细胞牢固地附着在内皮上。ICAM-1和L-选择素甚至已被证明通过调节肿瘤淋巴细胞浸润共同促进抗肿瘤反应。除此之外,LFA-1 介导 NK 细胞与靶细胞的粘附、免疫突触的成熟,并且对于颗粒极化和有效杀伤至关重要。
根据我们的数据,IL-2扩增的NK细胞不显示任何 L-选择素表达或仅显示低表达。无论如何,在用 IL-2激活后,所有供体的 NK 细胞都会上调 L-选择素的表达(图 7A)。与这种上调相反,整合素LFA-1(图 7B)和VLA-4 已经在 IL-2 扩增的 NK 细胞上大量表达(图 7C)。然而,IL-2 再刺激导致 LFA-1和VLA-4表达的额外增加。仅在供体1的情况下,IL-2诱导的LFA-1 表达没有增加。
激活受体的表达
NK 细胞配备了一组不同的受体,这些受体识别其他细胞表面的分子,产生抑制或激活信号。NK 细胞反应最终受两种信号类型之间的平衡调节。
通常,激活受体识别受伤、感染和恶性细胞上的分子。NKp30、NKp44 和 NKp46 属于天然细胞毒性受体 (NCRs) 组,它们是 NK 细胞细胞毒性的重要介质,一些研究甚至表明 NCRs 代表了 NK 细胞杀死肿瘤细胞靶标的主要机制之一。因此,阻断这些受体会导致体外对恶性细胞和感染细胞的杀伤力受损,体内低表达水平与例如白血病细胞对急性髓性白血病患者的 NK 细胞毒性的抗性相关。即使仅删除一个 NCR 也已被证明会损害 NK 细胞介导的体内肿瘤细胞裂解。
我们在五个不同供体的 NK 细胞上发现了所有三种受体的表达。NKp30(图 8A)和 NKp44(图 8B)已经在 IL-2 扩增的 NK 细胞上表达,而 NKp46(图 8C)在这些条件下几乎不存在。无论如何,用 IL-2 重新刺激导致所有三种受体的表达增加。仅在供体 1 的情况下,我们无法检测到 IL-2 激活后 NKp44 的任何增强表达(图 8B,左)。
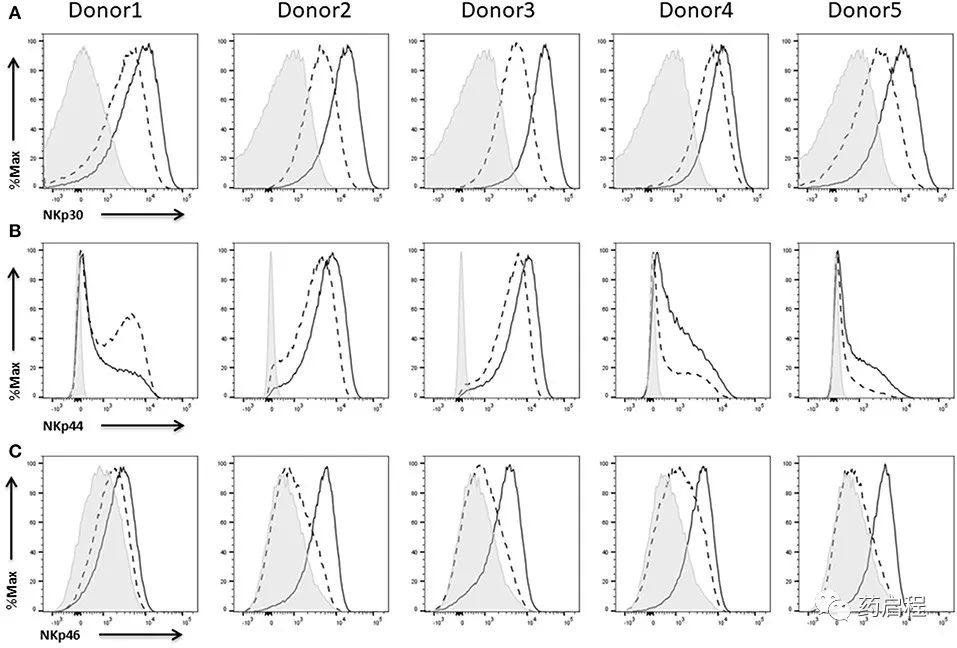
DNAM-1 是 NK 细胞上另一个重要的激活受体,可控制细胞毒性以及针对多种转化和感染细胞的 IFNγ 产生。作为 NKG2D,DNAM-1 已被证明参与针对前列腺癌、卵巢肿瘤和多发性骨髓瘤等不同肿瘤的免疫反应。
我们可以在所有五个供体的NK细胞上显示强NKG2D(图 9A)以及 DNAM1(图 9B)表达。两种受体的表达不需要 IL-2 重新刺激细胞,但 IL-2 激活增强了来自所有供体的 NK 细胞上的 NKG2D 表达水平(图 9A)和来自供体 2-5 的 NK 细胞上的 DNAM1 表达水平(图 9B)。
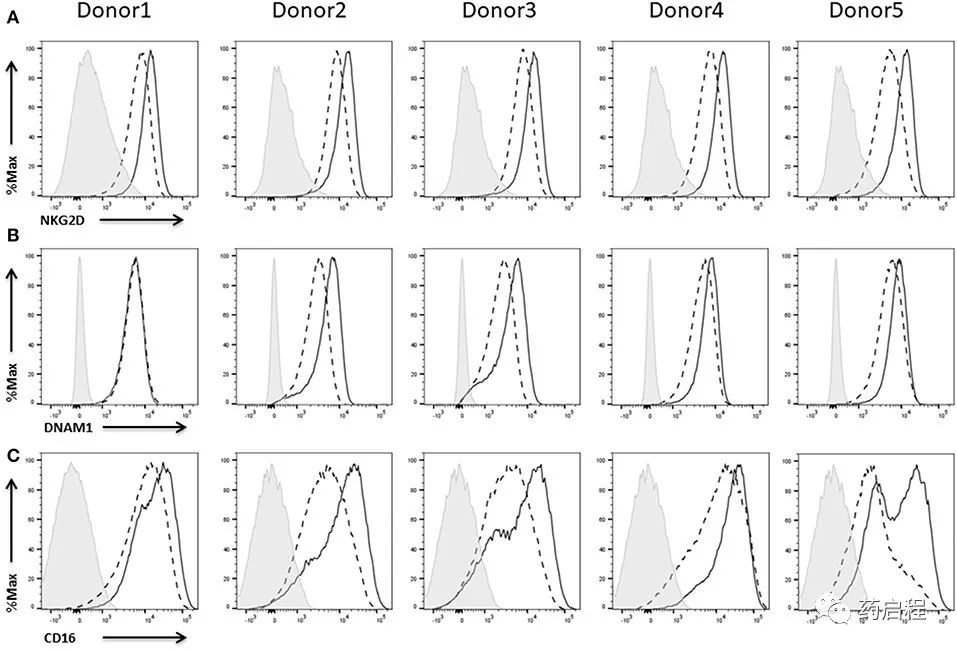
作为IgG抗体的低亲和力受体,CD16是NK细胞上另一个重要的激活受体,可促进抗体依赖性细胞介导的细胞毒性 (ADCC)。
描述了不同的 NK细胞亚群,它们在表型和功能方面有所不同。已根据 CD56 的细胞表面密度和CD16的表达确定了两个主要的NK细胞亚群。在这种情况下,CD16的表达与 NK 细胞的细胞毒性以及细胞因子的产生有关。因此,CD16+ NK细胞可以自发地裂解靶向肿瘤细胞,而CD16- NK细胞是有效的细胞因子生产者,几乎没有杀死肿瘤细胞靶标的能力。所有五个供体的大多数NK细胞对CD16呈阳性。此外,在所有情况下,用IL-2重新刺激48小时导致CD16表达上调(图 9C)。
死亡配体的表达
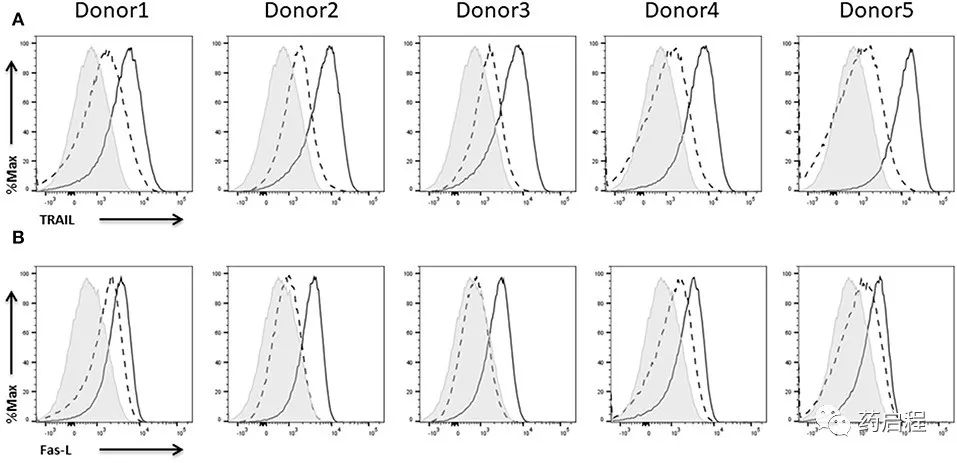
NK细胞杀死其靶标的两种主要机制之一涉及通过将其同源配体结合到NK细胞上从而激活靶细胞上的死亡受体,从而诱导靶细胞凋亡。研究表明,死亡受体介导的细胞凋亡的抑制伴随着肿瘤进展的增强,已经强调了该途径的重要性。NK细胞已被证明表达死亡配体 FasL 和 TRAIL。
TRAIL 在所有五个供体的 NK 细胞上的表达在用 IL-2 激活之前相当弱,在用 IL-2激活后强得多(图 10A)。FasL 表达的结果非常相似。根据供体的不同,IL-2 扩增的 NK 细胞没有显示任何 FasL 表达或仅显示低表达(图 10B)。无论如何,在用IL-2重新刺激后,所有供体的 NK 细胞都显示出 FasL 表达。为了更好地评估不同肿瘤细胞系对死亡受体诱导的杀伤的敏感性,我们分析了所有三种细胞系上的死亡受体表达。
细胞毒性
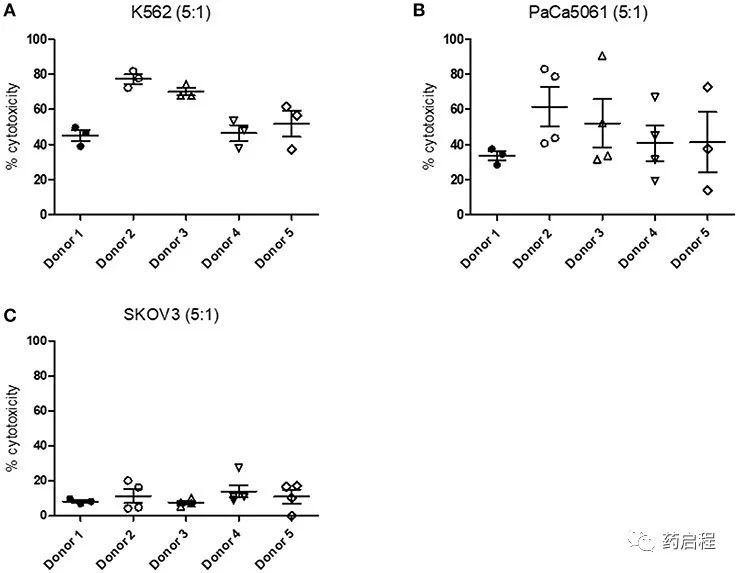
为了分析 NK 细胞对不同肿瘤细胞系的细胞毒性,我们进行了 LDH 测定。因此,NK 细胞分别与 K562、PaCa5061 和 SKOV3 肿瘤细胞共培养。测量的细胞毒性取决于供体和使用的细胞系。来自供体 2 和供体 3 的 NK 细胞对 K562 细胞的细胞毒性范围为约 40% 至 80%,显示出比来自其余三个供体的 NK 细胞更高的细胞毒性(图 11A)。
我们可以进一步测量对 PaCa5061 细胞的细胞毒性,平均在 30%和60% 之间(图 11B)。不幸的是,我们观察到单次测量之间的变异性非常高。与 K562 和 PaCa5061 细胞相比,SKOV3 细胞对 NK 细胞介导的杀伤不太敏感(图 11C)。平均而言,细胞毒性不超过20%。一般来说,测量的细胞毒性进一步取决于 E:T 比。
脱颗粒和 IFNγ 表达
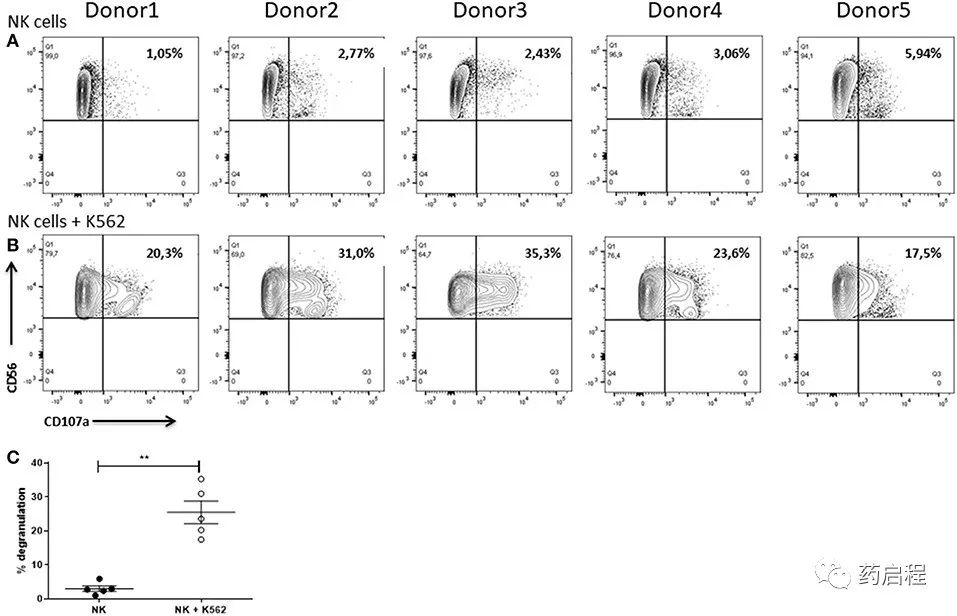
作为细胞毒性潜力的额外读数,我们通过使用流式细胞术在不存在或存在 K562 细胞的情况下培养 6 小时后分析 CD107a 作为脱粒标记物的表达来评估 NK 细胞的脱粒。根据相同的实验,我们还测量了 IFNγ 的细胞内表达。简而言之,在排除细胞双联体后,NK 细胞被鉴定为 CD56+ 细胞。随后分析了 NK 细胞的 CD107a 和 IFNγ 表达。
只有低频率的单独培养的 NK 细胞 (1.05-5.94%) 对 CD107a 呈阳性(图 12A)。无论如何,与 K562 细胞共培养的 NK 细胞显示出更高的脱颗粒,CD107a+ 细胞高达 35.3%(图 12B)。此外,共培养时 CD107a+ 细胞的频率高度依赖于供体。例如,只有 17.5% 的 CD107a+ 细胞供体 5 的脱颗粒作用比具有 35.3% 的 CD107a+ 细胞的供体 3 弱得多(图 12B)。统计分析表明,当 NK 细胞与 K562 细胞一起培养时,它们的脱粒显着增强(图 12C)。
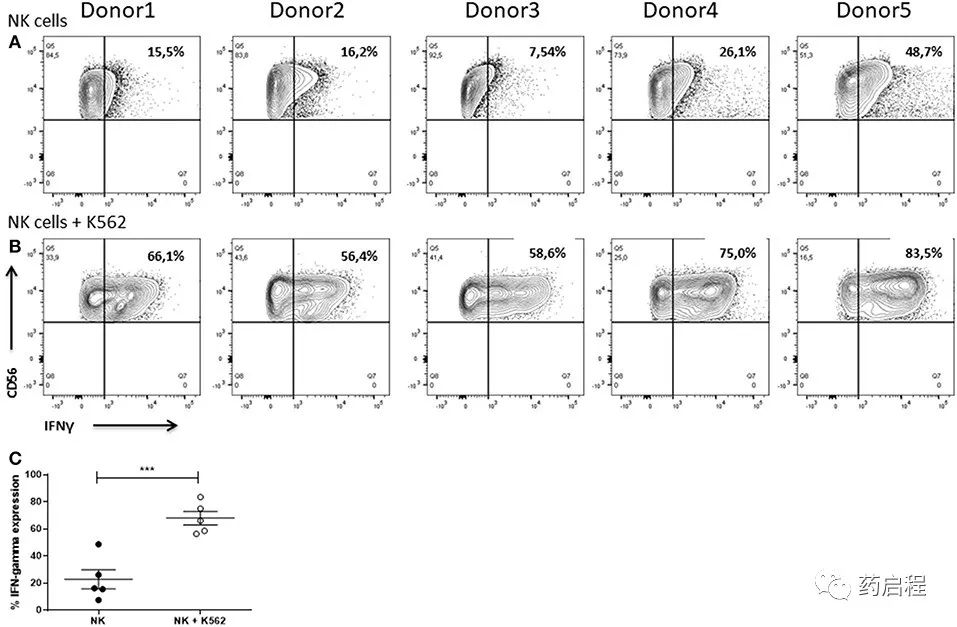
NK 细胞是有效的细胞因子生产者,在识别靶细胞后会分泌特别是IFNγ。这种促炎细胞因子的释放有助于靶细胞的细胞溶解并进一步加强免疫反应,例如,通过驱动 Th1 分化、增强巨噬细胞功能、支持白细胞迁移到感染部位和增强主要组织相容性感染或恶性细胞上的复杂表达。
当单独培养时,所有供体的 NK 细胞已经显示出 IFNγ 的产生(图 13A)。在所有情况下,NK 细胞与 K562 细胞共培养 6 小时导致细胞因子产生增加。然而,供体之间的 IFNγ+ NK 细胞频率不同,范围从 56.4% 到 83.5%(图 13B)。统计分析表明,与 K562 细胞共培养显着增强了 NK 细胞中的 IFNγ 表达(图 13C)。
结论和未来展望
迄今为止,根据世界卫生组织的数据,癌症仍然是全球第二大死因,大约 90% 的癌症死亡与远处转移的形成有关。由于已知 NK 细胞控制循环肿瘤细胞并通过这种机制防止转移形成,因此 NK 细胞免疫疗法是一种很有前景的癌症治疗方法。除了杀死循环肿瘤细胞外,NK 细胞还能够浸润实体瘤,并且已经证明高 NK 细胞浸润与患者在不同癌症实体方面的更好预后相关。
在自体 NK 细胞的过继转移仅取得有限的成功后,研究集中在同种异体 NK 细胞作为癌症免疫治疗的潜在候选者。因此,为了提高 NK 细胞的产量和特异性细胞毒性,已经进行了几项研究。
在这项研究中,我们使用补充有初始活化混合物的培养基扩增了人类 T 细胞耗尽的 PBMC,并获得了纯度超过 85% 的 NK 细胞,在三种情况下甚至超过 90%。对于预期的治疗应用,NK 细胞纯度是一个重要因素,因为非NK细胞,尤其是 T 细胞和 B细胞,可能会引起不良副作用,包括移植物抗宿主病。
在我们的过程中,我们在体外扩增后获得的细胞级分中几乎不存在 T 细胞和 B 细胞。到目前为止,已经描述了使用各种不同的试剂(包括 IL-2 和 IL-15)以及不同的培养系统体外培养人 NK 细胞的多种方法。在许多情况下,NK 细胞纯度保持在相当低的水平,有时甚至低于 50%,这使我们的培养系统成为非常有吸引力的替代方案。
为了获得完整的功能和强大的杀伤能力,NK 细胞需要一组不同的表面分子。首先,它们需要调节组织分布并将细胞引导至肿瘤部位的趋化因子受体。所有五个供体的 NK 细胞均表达 CXCR3、CXCR4 和 CCR7,表明 NK 细胞可以被募集到作用部位。CXCR3 表达可能对癌症治疗特别感兴趣,因为它调节 NK 细胞向实体瘤中的募集。
除了趋化因子受体外,NK 细胞还表达组织侵袭和形成 IS 所需的所有粘附分子,这对于有效杀死靶细胞至关重要。最重要的是,分析的 NK 细胞显示 NCRs NKp30、NKp44 和 NKp46 以及激活受体 NKG2D 和 DNAM-1 的表达,这些受体都已知对 NK 细胞的细胞毒性有很大影响。因此,许多方法已经旨在增强上述受体的表达。此外,所有五个供体的 NK 细胞都表现出 Fc 受体 CD16 的强烈表达,这与细胞的高细胞毒性有关。
如前所述,除了通过激活受体激活 NK 细胞外,它们还可以通过死亡配体/死亡受体相互作用诱导靶细胞凋亡。根据之前的研究,IL-2 扩增的 NK 细胞仅显示出死亡配体的低表达,而死亡配体在 IL-2 再刺激时上调。死亡配体的表达表明生成的 NK 细胞能够诱导靶细胞凋亡。总之,来自不同供体的 NK 细胞在所分析受体的表达方面似乎没有太大差异。
从 LDH 细胞毒性试验和脱颗粒试验中获得的结果表明,测试的 NK 细胞具有细胞毒性,能够杀死不同的肿瘤靶细胞,尽管白血病细胞比例如 SKOV3 细胞更容易受到 NK 细胞介导的细胞毒性的影响,这可以解释通过 SKOV3 细胞的上皮形态。与淋巴细胞相反,它们通常不会作为单个细胞出现,而是形成牢固的结合。观察到的关于 LDH 细胞毒性测定的不同测量之间的高变异性可以用肿瘤细胞的异质大小来解释。测量的细胞毒性表明 NK 细胞表达的细胞粘附分子成功地形成了 IS。
促炎细胞因子 IFNγ 的分泌是 NK 细胞履行不同功能的一个重要特征。除了其一般的免疫调节活性,IFNγ 在肿瘤监测中也发挥着重要作用。它具有促凋亡作用,抑制肿瘤血管生成,显示出抗转移活性,甚至支持 NK 细胞浸润肿瘤。所有测试的 NK 细胞的强 IFNγ 表达证明了高抗肿瘤活性,这可以通过进行的 LDH 和脱颗粒测定来证明。NK 细胞的细胞毒性和 IFNγ 表达似乎都受到献血者的影响。生物测定,例如此处使用的细胞毒性测定,通常会受到较大的供体依赖性差异的影响。造成这种情况的原因是多方面的,例如性别、年龄、营养等。
这些体外实验永远无法完全模拟给定肿瘤的体内情况。特别是,我们的研究无法调查细胞粘附分子的表达是否与 NK 细胞从血流到肿瘤部位的有效募集密切相关。此外,有许多因素包括影响体内 NK 细胞功能的不同细胞因子。尤其是肿瘤微环境非常复杂,可能会干扰 NK 细胞功能。例如,TGFβ、IL-10 或免疫抑制酶可能会损害 NK 细胞活性,例如通过调节不同受体的表达模式。因此,我们计划研究异种移植小鼠模型中的 NK 细胞功能。
从我们的角度来看,最重要的方面之一是在培养过程中营养物质(尤其是葡萄糖)和气体在总培养基流中的均匀分布。在此处介绍的灌注生物反应器系统中,培养基在整个培养时间内的均匀性是通过由曲流培养床强制的培养基定向层流来实现的。这些层流灌注生物反应器中的中等流量与天然血管中的血液流量相当,葡萄糖浓度在类似于体内条件的狭窄范围内进行调节。因此,避免了代谢细胞应激。扩增过程中稳定增长的 NK 细胞数量由一方面循环培养基和另一方面新鲜培养基喂养/细胞肉汤去除之间的合适比例所补偿。
未来的研究应侧重于更深入地表征培养条件(批次、灌注)的影响。总的来说,我们支持在静态条件下培养 NK 细胞、分批补料或湍流条件(例如,在搅拌容器中)不应再作为 NK 细胞扩增的选择,因为葡萄糖浓度和其他代谢物的上升和下降是远离骨髓中的生理条件并避免可重复的 NK 细胞扩增。这里描述的 NK 细胞的离体扩增不仅用于增加细胞数量的目的,而且还通过上调不同激活受体的表面表达产生了一种具有改善的抗肿瘤潜力的新 NK 细胞类型。
时间:2022年1月9-10日
地点:上海(酒店定向通知)
规模:500-600人
主办单位:四叶草会展、生物制品圈
协办单位:香港奥星集团
媒体支持:药时空、抗体圈、药创客
会议费用:为细胞和基因治疗领域研发人员提供参会福利,12月15日之前报名FREE!(仅收取50元定金,含茶歇、会议资料等,定金概不退还)(如需用餐,2天午餐加收150元),先到先得,报完即止,12月15日以后报名将收取会议费!请提前锁定!
报名方式:扫描下方二维码或点击文章最底部“阅读原文”→ 填写表格 → 报名成功(报名志愿者,免交定金,承担一定工作任务)!

组委会获得报名信息后,根据报名信息进行初筛,并进一步与报名者沟通确认,实现精准邀请。最终有机会进入大会微信群(严格审核通过)。

主要议题和内容

已经确定的报告人介绍



更多报告人正在邀请中,以最终版日程为准
点击即可查看往期日程
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区






