
目前被批准用于EGFR突变晚期非小细胞肺癌(NSCLC)的靶向药物包括一代,二代和三代EGFR-TKI。在既往随机对照研究中,奥希替尼(Osimertinib)作为三代EGFR-TKI相比传统的一代/二代EGFR-TKI显示出更佳生存获益,AURA3的主要终点为PFS,结果显示,与双药化疗方案相比给予奥希替尼治疗能显著提高患者的PFS(11.0个月与4.2个月,HR为0.28,P<0.001)[1]。但临床中应用奥希替尼治疗仍不可避免出现耐药,如何将奥希替尼治疗中获得的PFS延续下去的问题成为了我们不断探索的主旋律。奥希替尼治疗进展后,对活检标本进行二代测序(NGS)分析有助于探索导致奥希替尼耐药的关键分子机制,并指导后续的治疗策略,为晚期NSCLC患者争取更长的生存期。然而迄今为止,真实世界队列研究中,基于NGS活检样本基因分型的作用的数据十分有限。
为了探索国内真实世界中奥希替尼耐药后治疗策略及生存情况,广东省人民医院杨衿记教授团队与燃石医学合作,共同开展了一项单中心、回顾性研究,旨在探索奥希替尼进展时对活检标本进行组织学和分子标志物分析对于改善生存预后的重要意义,并期待通过分析患者在奥希替尼进展后组织学和基因谱变异情况、进展后治疗方案的制定及进展后生存情况,提供更多基于临床的奥希替尼进展后个体化的治疗方法。2020年10月20日,该研究成果在Lung Cancer(IF= 4.702)发表。

■ 研究人群
该研究纳入2017年1月至2019年7月间,二线及二线以上接受奥希替尼治疗的89例EGFR T790M阳性晚期NSCLC患者。主要研究终点为奥希替尼进展后生存期(pPFS,定义为从奥希替尼进展到进一步治疗的进展时间)和进展后总体生存期(pOS,定义为从奥希替尼进展到死亡或最后一次随访的时间)。
■ 研究结果
1、与化疗相比,奥希替尼进展后接受靶向治疗没有显著改善pPFS或pOS
奥希替尼治疗进展后的治疗策略分为靶向治疗、化学治疗或最佳支持治疗(BSC),三者之间的pPFS和pOS存在显著差异(图1)。两两分析发现,靶向治疗组的pPFS较BSC组显著更长(HR=0.44,P=0.017),但是,靶向治疗组和化疗组(HR=0.76,P=0.285)以及化疗组和BSC组(HR=0.59,P=0.138)之间的pPFS没有显著差异。与BSC组相比,靶向治疗组(HR=0.24,P<0.001)和化疗组(HR=0.23,P<0.001)的pOS显著更长,但靶向治疗组和化疗组的pOS结果相似(HR=1.037,P=0.903)(图1)。
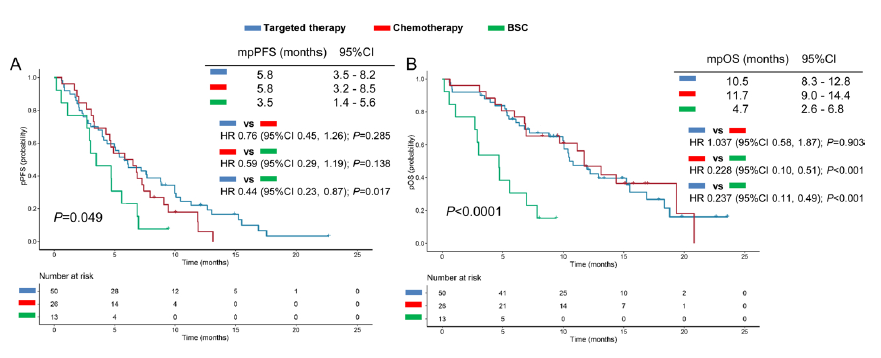
图1:靶向治疗、化疗和BSC组的中位pPFS和pOS
2、奥希替尼治疗进展后对活检标本进行分析改善了生存结果
在奥希替尼治疗进展时对活检标本进行分子标志物分析可以显著改善患者生存(再活检组vs非再活检组, 中位pPFS分别为6.1个月 vs. 3.3个月,HR=0.55,P=0.016;中位pOS分别为11.7个月 vs. 6.8个月,HR=0.51,P=0.013)(图2)。
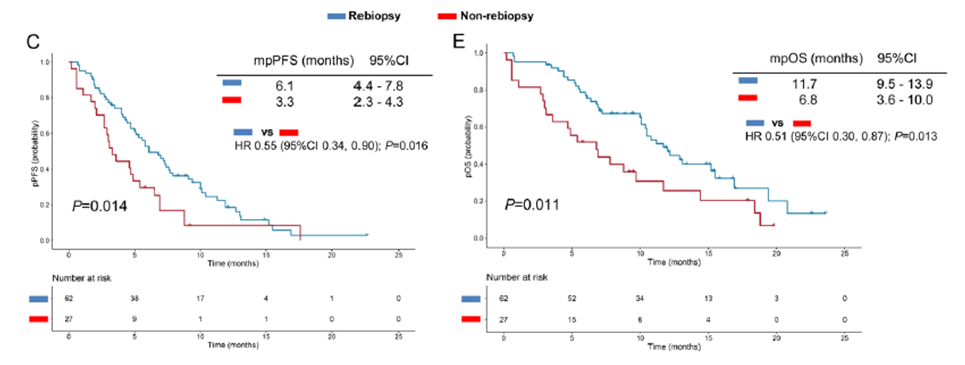
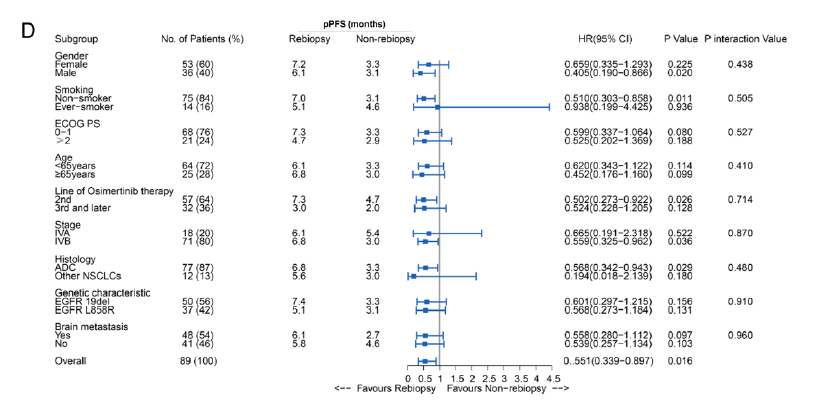
图2:再活检组与非再活检组的中位pPFS和pOS
3、具有高证据级别的匹配治疗可提供更好的生存获益
根据分析结果,与未接受匹配治疗的患者相比,接受相匹配治疗方案患者的pPFS和pOS显著更长(pPFS 分别为7.4个月 vs. 5.1个月,P=0.020;pOS分别为15.2个月 vs. 10.1个月,P=0.006)。并且方案制定的证据级别(根据NCCN指南)越高,患者的预后越好。与未接受匹配治疗或接受低水平匹配治疗的患者相比,接受高度匹配治疗患者的pPFS和pOS明显更长(图3)。
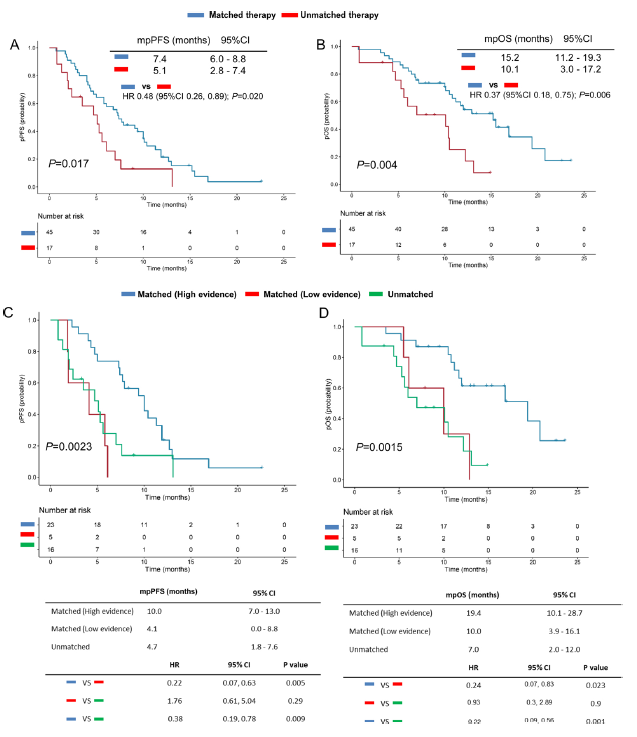
图3:匹配治疗组、未接受匹配治疗组、高度匹配治疗组、低水平匹配组的中位pPFS和pOS
在这项回顾性队列研究中,由于对标志物的识别以及相匹配的进一步治疗策略的选择,研究者观察到了在奥希替尼进展后接受组织学和分子分析患者的良好生存结局。根据再活检标本的分子分析,我们检测到的4种奥希替尼耐药机制发生比例如下:EGFR依赖性耐药即EGFR通路突变(14.5%)、EGFR非依赖性耐药即旁路途径(37.1%)和组织学转化(16.1%)和未知机制(32.3%)。
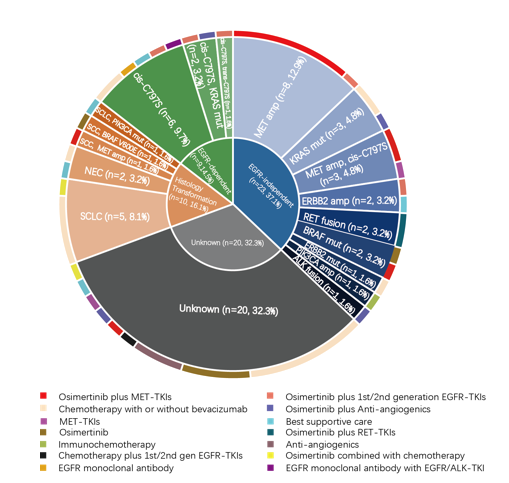
图4:基于组织学和分子标志物的治疗情况分析
4、奥希替尼联合MET-TKI治疗MET扩增患者的ORR率高达50%
MET扩增是本研究中最常见的EGFR非依赖性耐药机制,有约23%的患者被检测到了MET扩增阳性。在10例接受了奥希替尼联合克唑替尼或其他MET-TKI(包括Savolitinib和Bozitinib等)治疗方案的患者中,有5例达到了部分缓解(PR),1例达到了疾病稳定(SD),客观缓解率(ORR)为50%,疾病控制率(DCR)为60%(图5)。结果表明,结合基于NGS的基因分型与再活检标本的组织学评估,有助于揭示耐药机制和选择最佳治疗决策。
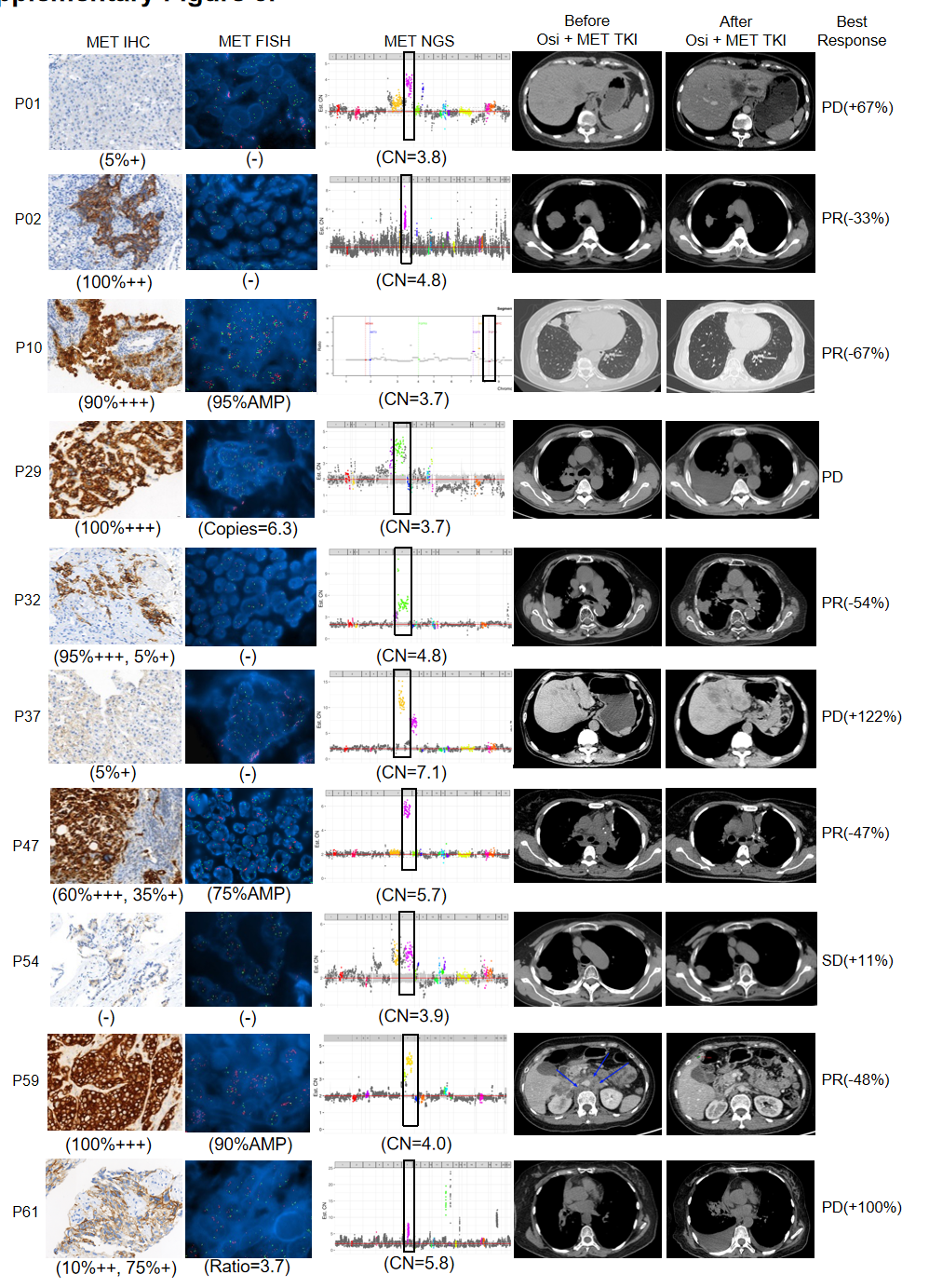
图5:10例接受奥希替尼联合MET-TKI治疗患者临床疗效评估
本研究中MET扩增阳性患者在接受了奥希替尼联合克唑替尼或其他MET-TKI(包括Savolitinib和Bozitinib等)的治疗方案后,ORR达到了50%(5/10)(图5),高于TATTON研究报告的30%(21/69)。但是需要指出的是,与TATTON研究的B1亚组不同,参与本研究的患者是将奥希替尼作为二线或二线以上方案使用的,并且对于MET扩增阳性的定义也不同于TATTON研究,本研究将NGS结果作为主要阳性判定标准。随后对这些NGS结果显示MET扩增阳性,并接受了奥希替尼联合MET-TKI方案治疗的10位患者的组织标本进行回顾性MET FISH和IHC的检测后,发现只有60%(6/10)的患者在接受含MET-TKI方案之前明确有FISH检测的MET CNs 阳性。这说明基于NGS的MET CNs检测能够鉴定出对MET-TKI治疗有效的MET扩增事件,尤其是那些仅凭FISH或IHC检测结果可能会被遗漏掉的MET CNs阳性。减少临床上这部分患者可能因未接受到匹配的治疗方案,而无法获得更好疗效、更长生存的遗憾。但是基于NGS检测的MET CNs阳性阈值仍需进一步确认。
■小结与启发:奥希替尼进展后再活检的漫漫探索之路
迄今为止,尚未出现基于活检耐药分子机制和组织表型转化分析制定治疗策略显著改善后续生存期的研究,而本研究首次提供临床证据,证明奥希替尼治疗进展后,进行基于NGS的肿瘤再活检或其他生物样本评估,有助于识别基因型和/或表型标记分析耐药机制,增加个体化治疗机会,改善患者生存结局。
目前奥希替尼耐药的机制主要分为四类:EGFR依赖性通路激活,EGFR非依赖性通路激活、组织类型转化及未知机制[2]。MSKCC机构曾在2019年的ASCO上首次公布了基于组织活检的奥希替尼耐药机制研究,而后该研究于今年发表于CCR(Clinical Cancer Research)杂志上[3]。研究对比了奥希替尼一线用药和后线用药的耐药机制,发现相较于后线用药,一线使用奥希替尼耐药后除了存在着更大比例的未知机制,且其EGFR通路依赖性耐药机制(主要是EGFR C797S突变)的发生率也要明显低于后线。表明一线与后线使用奥希替尼可能具有不同的耐药谱。
FLAURA研究中长达18.9个月的PFS迅速奠定了奥希替尼在晚期EGFR突变型NSCLC一线治疗中的地位[4]。今后一线奥希替尼耐药后也可能需要进行基于NGS的肿瘤再活检或其他生物样本评估(耐药分子机制和组织表型转化分析),增加个体化治疗机会,改善患者生存结局。期待将来能够开展更多的前瞻性研究进行更深入的探索!

杨衿记教授
主任医师,博士生导师,博士后合作导师
广东省人民医院肿瘤中心党总支书记、肿瘤中心主任、肿瘤中心肺一科主任;
广东省医师协会肿瘤内科医师分会主任委员;
广东省抗癌协会肺癌专业委员会主任委员;
中国临床肿瘤学会(CSCO)理事;
主持2项国家自然科学基金面上项目、1项国家科技部慢病重大项目子课题和2项省自然基金面上项目;
以共同完成人获得国家科技进步奖二等奖1次、中华医学科技奖一等奖1次、省科学技术一/二等奖各2次 ;
2018年度“广东好医生”。2019年度“国之名医·优秀风范”奖。
参考文献
1. Mok TS, et al. Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer.
N Engl J Med, 2017.376(7):629-640.
2. AJ, P.-V., S. LV, and P. Z, Emerging Treatment Paradigms for EGFR-Mutant Lung Cancers Progressing on Osimertinib: A Review. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2020: p. JCO1903123.
3. AJ, S., et al., EGFRTumor Analyses Reveal Squamous Transformation and Off-Target Alterations As Early Resistance Mechanisms to First-line Osimertinib in -Mutant Lung Cancer. Clinical cancer research : an official journal of the American Association for Cancer Research, 2020. 26(11): p. 2654-2663.
4. Ramalingam SS, et al. 2017 ESMO Abstract LBA2.
关于燃石医学
燃石医学(纳斯达克代码:BNR)成立于2014年,公司使命为“用科学守护生命之光”,专注于为肿瘤精准医疗提供具有临床价值的二代基因测序(NGS)。公司业务及研发方向主要覆盖:1)基于NGS的肿瘤患病人群检测;2)基于NGS的癌症早检,目前已经进入临床验证阶段。燃石医学于2018年7月获国家药品监督管理局(NMPA)颁发的中国肿瘤NGS检测试剂盒第一证,在体外诊断领域具有里程碑式意义。实验室获得广东省临检中心颁发的“高通量测序实验室”技术审核,以及美国CLIA和CAP实验室质量体系资质认证。公司将继续致力于开发创新可靠的NGS检测产品,推动肿瘤精准医疗领域的发展。



 个人中心
个人中心
 我是园区
我是园区




