
- 导读 -
2020年10月22日,泛生子(纳斯达克代码:GTH)宣布与杭州艾沐蒽生物科技有限公司(以下简称“艾沐蒽”)签订独家许可协议,获得其血液肿瘤微小残留病(Seq-MRD)产品的全球独家许可,并将加速产品开发和商业化。根据协议,泛生子将拥有使用艾沐蒽的Seq-MRD®技术进行研发、注册、商业化血癌MRD检测产品的专有权。本文将围绕MRD在血癌临床中的应用、相关检测技术的发展变迁及前瞻性的应用方向等方面进行解读,此业务战略整合会为血液肿瘤临床诊疗领域带来哪些价值和未来可能的深远影响?身处精准医学时代,随着新技术和好产品的不断涌现,将大大加速个体化医疗进程,为广大患者带来更多获益。
一、血液肿瘤发病背景简介
血液肿瘤是一类常见但复杂的癌症类型的统称,主要包括各类白血病、多发性骨髓瘤以及恶性淋巴瘤,是一类具有高度异质性的疾病,对患者及其家庭都有巨大影响。以骨髓瘤为例,通过诱导化疗等治疗方案,可使得大约80%的成人患者达到临床缓解。在这其中依然会有约72%的患者出现因免疫逃逸从而导致的疾病复发,骨髓移植后10-15年的生存率也仅保持在15%左右[1]。急性淋巴细胞白血病(Acute Lymphoblastic Leukemia, ALL)是成人最常见的急性白血病类型,根据现行的系统性诱导化疗方案,有85~90%的患者会出现临床缓解,但这部分患者仍会存在60~70%的复发[2]。相比于儿童急性淋巴细胞白血病90%的存活率,成人急性淋巴细胞白血病的预后并不能令人满意[3]。
微小残留病变(Minimal Residue Disease,MRD)是指患者在接受治疗后处于临床缓解期,无临床症状但在体内仍然存在肿瘤细胞的状态。MRD状态在实际中被用于指导治疗[4],根据是否适合骨髓移植[5]和预测复发情况[6]对患者进行危险度分层。它还可用于指导临床研究中的治疗决策[7,8]。一项关于急淋白血病(ALL)的研究显示,MRD阴性与无复发生存期延长4倍,总生存期延长3倍具有显著相关性[6]。加州大学旧金山分校的医学博士Aaron Logon呼吁必须将治疗转向针对MRD的靶向和消除。MRD阳性亦被美国FDA认可为具有临床指导意义的指标,基于一项涉及706名成人多发性骨髓瘤(MM)患者国际研究结果,美国FDA最近批准了针对MM患者一线治疗的CD38靶向单克隆抗体疗法[9]。评估患者接受此治疗前和治疗后多个时间点的MRD水平,发现 MRD阴性与显著延长的无进展生存期相关[10]。血液恶性肿瘤的临床实践指南指出,MRD状态是临床结果和对治疗反应的可靠指标,并且临床结果与诊断为ALL和MM患者经clonoSEQ Assay测量的MRD水平密切相关。在多发性骨髓瘤美国国立综合癌症网络(NCCN)指南[11],IMWG共识标准和ESMO骨髓瘤临床实践指南[12]中建议在每个治疗阶段后使用经过验证的分析方法进行MRD评估;急淋白血病NCCN指南建议在完成初始诱导后对ALL成人患者进行MRD检测,MRD检测的其他时间点应遵循所使用的治疗方案。NCCN指南还建议使用MRD检测来确定第一次或第二次完全缓解但MRD阳性的患者,应使用blinatumomab治疗[13]。
一项Meta数据分析研究了14项已发表的研究成果,其中包括1273名MM患者,并量化了生存结果与MRD状态之间的关系。发现MRD阴性与无进展生存期和总生存期相关。MRD检测的预后价值的证据适用于所有疾病亚型、年龄、治疗方案、检测的治疗阶段和MRD检测方法。MRD阴性与中位无进展生存期(PFS)相关,MRD阴性患者的PFS(54个月)超过MRD阳性患者(26个月)两倍时间[14]。
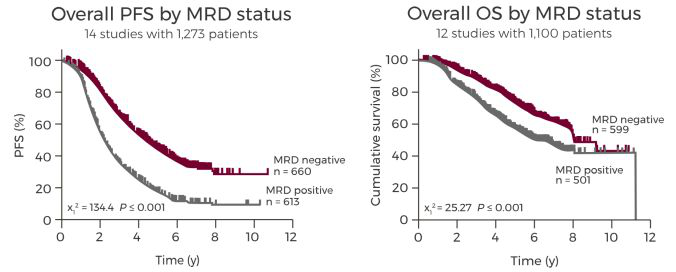
图1. 一项MRD预测多发骨髓瘤(MM)的Meta研究。
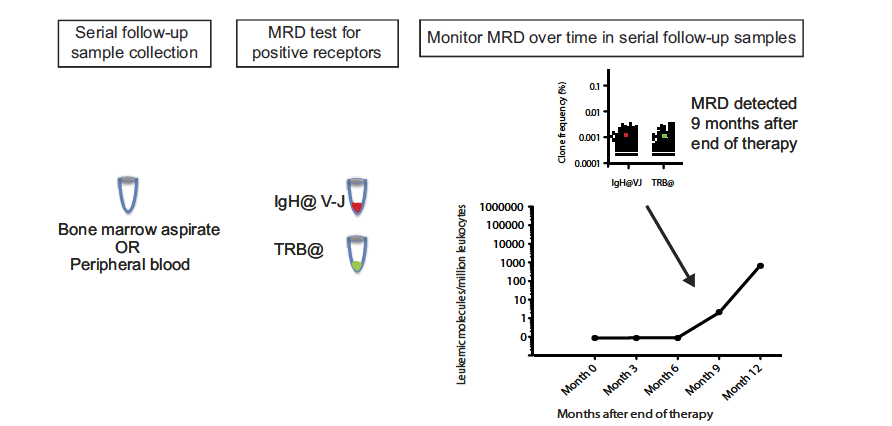
图2. 临床诊疗MRD检测流程图示。
三、MRD检测技术方法对比
MRD是在分子水平上对疾病状态进行检测。在此之前,对血液肿瘤的复发检测历经了传统的形态学评估、流式细胞术、影像学评估以及分子生物学评估等阶段。无论采用何种方式,在患者接受治疗的过程中,都需要对患者的血液或骨髓样本进行检测,了解其中肿瘤细胞的存在数量以及类型。能够识别出远低于5%原始细胞阈值的残留病变,是提高风险分类与预后的关键要素。在这样状态下残存的肿瘤细胞数量很少,且没有临床症状,所以不易察觉,但肿瘤的复发也往往源于此,因此才需要有更加准确和灵敏的方法对MRD进行检测,从而获知治疗的效果和复发可能性。
形态学评估是应用时间最长的评估方式,已经沿用了一个多世纪,但其灵敏度只能维持在约5%,即在每20个细胞中检出1个白血病细胞[15]。起步于上世纪80年代的流式细胞术,大幅度的提高了MRD的检测灵敏度。例如,通过使用荧光标记对多发性骨髓瘤相关的细胞进行表面标记,使其能够被激光照射时得以被记录而获知其所占比例,与显微镜计数相比,流式细胞术的灵敏度可以提高到10-4~-5之间,即可在10,000-100,000个细胞中检测到1个骨髓瘤细胞[16],但受限于流式细胞仪的激光波长种类和可选的荧光标记,样本的新鲜程度,以及操作人员经验与细胞类型评价也具有较强的主观性,使得其并不容易形成统一的临床检测标准。PET-CT是近年来新型的影像学诊断技术,其也可应用于骨髓瘤等血液肿瘤的影像学评估,并已被NCCN所接受[17],但该技术的应用仍然面临着灵敏度低,对身体有辐射性且价格昂贵等问题,无法成为临床上广泛应用的监测方法。随着分子生物学实验技术的快速发展,其应用也逐渐扩展到了血液肿瘤相关领域。荧光定量实时PCR技术的不断完善,使得其已经在上世纪末被逐渐应用于MRD的检测。根据其实验原理,采用PCR技术的MRD检测灵敏度可以达到10-5~-6,可在10-100万个细胞中检测到1个骨髓瘤细胞[18]。但PCR技术只能检测已知的序列突变,不能对未知的基因重组进行检测和定量白血病细胞的数量和来源,使其临床应用也受到很大的局限。
随着基因测序技术的不断迭代,目前的二代测序技术(NGS)已经可以用来对众多肿瘤标志物panel进行高通量检测,其应用也逐步拓展到血液肿瘤。淋系白血病指的由淋巴系统细胞(主要为B细胞和T细胞)克隆性增殖导致的癌症,因此可以通过对TCR和BCR测序特异性识别癌细胞。人体中的T细胞受体(TCR)是T细胞特异性识别和结合抗原肽MHC的分子结构。在组成TCR的α、β、γ、δ肽链中,β链中互补决定区3的多样性使得T细胞能够识别各种各样的抗原。而这样的多样性是通过体细胞V(D)J基因重排产生的。由于V,D,J基因片段本身就具有多样性,在重组过程中,在V-D和D-J的连接去还经常有核苷酸随机插入与缺失,这就进一步增加了肽链的多样性,TCR的总多样性可高达1015,而在任一个人体内的多样性通常为5000万种。B细胞受体(BCR)是由两条重链(H)和两条轻链(κ和λ)组成的四聚体,其中重链分为可变区(V区)、恒定区(C区)、跨膜区及胞质区;轻链则只有V区和C区。V区由3个互补决定区(CDR1、CDR2和CDR3)组成,CDR的基因组成和排列顺序呈现高度多样性,在同一个体内,这种多样性可高达109~12,从而构成容量巨大的BCR库。对于血液肿瘤而言,NGS的优势正好可以匹配免疫系统中数百万甚至数亿计各自不同的B/T细胞受体基因,从而对MRD进行更加准确的定量[19]。NGS对于MRD的灵敏度一直保持在10-6左右,这使得可以对某些特征性的肿瘤细胞进行靶向跟踪,考虑到NGS技术的不断平台化,其检测结果的稳定性也将大幅提高[20]。在2017/2018版《NCCN急性淋巴细胞白血病临床实践指南》、2017版《NCCN多发性骨髓瘤临床实践指南、》2016年版《中国成人急性淋巴细胞白血病诊断与治疗指南》和2017年版《中国多发性骨髓瘤诊治指南》中均推荐可使用NGS进行MRD检测方法。
2018年9月28日,FDA通过de novo 审批通道授予clonoSEQ 检测和商业化许可,clonoSEQ 可使用骨髓样本中的DNA检测和监测多发性骨髓瘤(MM)和B细胞急性淋巴细胞性白血病(ALL)患者的最小残留疾病(MRD)。ClonoSEQ 对血液中的MRD(微小残留白血病)极敏感,可以检测到低每一百万个细胞中至1癌个细胞的水平。
ClonoSEQ是第一个也是唯一一个FDA授权的用于MRD检测的体外诊断测方法。同时也是第一个通过免疫测序技术获得批准的临床诊断工具。该检测方法可对MRD进行标准化、准确和灵敏的测量,从而使医生能够预测患者的预后,评估随时间推移对治疗的反应,在缓解期间监测患者情况并检测潜在复发可能。
FDA对三项之前进行的临床研究(一项273例急性淋巴细胞白血病,一项正在进行的323例多发性骨髓瘤和一项706例多发性骨髓瘤)所得样本进行了回顾性分析评估,认可了该检测的临床有效性。对急性淋巴细胞白血病患者而言,clonoSEQ可用来评估在不同疾病负担阈值下的MRD水平,从而显示MRD水平与无事件生存相关---即患者在治疗后没有发生某些并发症或事件的时间长度。clonoSEQ检测结果为MRD阴性患者的无事件生存率较长,而MRD检测结果较高的患者无事件生存率较低。对多发性骨髓瘤患者而言,clonoSEQ检测给出了无进展生存时间与无疾病生存时间之间的相似关联性。
ClonoSEQ产品的成功,归因于Adaptive公司的专有免疫测序平台所积累的用于鉴定和定量恶性细胞的特定DNA序列的数据库,以及检测结果与临床结果的关联性的验证。
中国血液肿瘤MRD的潜在市场非常广阔,仅2017年,新增确诊的淋系血液肿瘤患者约为13.5万人,其中NHL患者超过8万例,ALL和CLL患者约3.5万例, MM患者约2万例。假设新发患者平均每年检测4次,每次价格3000元人民币,则潜在市场规模将达16亿人民币。而存量患者的潜在市场则更大,据悉,淋系血液肿瘤存量患者人数为新增患者的2-4倍[22]。假设存量患者平均每年检测2次,潜在市场规模可高达16-32亿人民币。Seq-MRD有望成为这些患者的标准MRD检测。
泛生子与艾沐蒽此次合作推出的Seq-MRD®是基于二代高通量测序技术(NGS),目前国内自主开发的唯一一款血液肿瘤微小残留病(MRD)检测产品,灵敏性可达10-6,相比传统的MRD检测方法,Seq-MRD®检测灵敏度提高10-100倍。在过去几年中,Seq-MRD®已经在国内完成数千例临床样本的验证。Seq-MRD®可适用于对血液肿瘤,如白血病、淋巴瘤、骨髓瘤等残留肿瘤细胞的识别、评估与监控。辅助临床医生预测长期疗效、评估治疗效果、监测缓解状态以及检测早期复发,从而为患者量身定制精准化的治疗方案,以实现全阶段癌症管理,提高患者临床疗效并降低医疗成本。
泛生子是中国领先的癌症精准医疗公司,专注于癌症基因组学研究和应用,并致力于依托先进的分子生物学及大数据分析能力改变癌症诊疗方式。致力于提供多应用场景的一站式分子诊断解决方案,包括癌症早期筛查、诊断与监测以及药物研发服务。
艾沐蒽是中国适应性免疫系统研究前沿的生物科技公司,自主研发的免疫分析医学平台可揭示和翻译适应性免疫系统的遗传密码,并致力于将其测序技术应用于癌症、自身免疫性疾病、传染性疾病等免疫介导性疾病的诊断和治疗中。
本次战略整合将进一步扩展泛生子在肿瘤诊断和监测领域的产品规划与布局,实现临床肿瘤患者不同检测需求的全覆盖,充分利用泛生子在精准医学分子诊断领域的研发、注册和商业化的优势,结合艾沐蒽的既往血癌产品及数据积累的优势。Seq-MRD®检测产品能够为目前血液肿瘤的患者提供更加精细化的临床诊断和治疗管理。据悉,泛生子计划推动Seq-MRD®检测产品的注册申报工作,获批后将会为血液肿瘤患者提供更加精细化的临床诊断和治疗管理,使患者更快的从技术创新中获益。
参考文献:



立即解锁你的掌上专业工具!



 个人中心
个人中心
 我是园区
我是园区




