
结核分枝杆菌(M. tuberculosis, Mtb)感染引起的结核病(Tuberculosis, TB)是重要的致死性慢性传染病,严重威胁全球人类健康。据世界卫生组织(WHO)报道,2019年全球约有1000万新发TB患者,约有141万人死于TB。Mtb是一种兼性胞内寄生菌,能够运用多种策略干预宿主细胞的正常功能从而逃逸宿主免疫反应,进而实现其在宿主细胞内的长期存活。中国科学院微生物研究所刘翠华课题组长期致力于研究Mtb等重要病原菌与宿主互作的分子机制,尤其聚焦Mtb利用宿主泛素系统调控宿主固有免疫反应的分子机制。
Mtb编码一系列真核样磷酸酶/激酶家族蛋白,其中真核样酪氨酸磷酸酶PtpA和真核样丝氨酸/苏氨酸蛋白激酶PknG均为分泌性效应蛋白,且与Mtb的胞内存活过程密切相关,因此PtpA和PknG一直是研发抗结核新药的重要靶点。深入研究PtpA和PknG干扰宿主免疫功能的分子机制,将有利于提供基于Mtb-宿主互作界面的抗结核新靶点,并为新型结核病预防及治疗药物的开发提供新策略。刘翠华课题组之前的研究发现Mtb PtpA与宿主泛素(Ub)相互作用,并先后揭示了PtpA通过在细胞质俘获Ub激活自身磷酸酶活性进而抑制宿主固有免疫反应的分子机制(Nature Immunology, 2015),以及PtpA在细胞核内以泛素非依赖的形式促进肿瘤细胞增殖的分子机制(Nature Communications, 2017)。
2021年5月2日,刘翠华课题组与北京师范大学邱小波教授团队以及微生物研究所高福院士团队的最新合作成果发表在EMBO reports上,题为 M. tuberculosis protein kinase G impairs host immunity by acting as an unusual ubiquitinating enzyme 。该研究首次发现Mtb PknG可与宿主泛素系统的一种关键蛋白—泛素耦合酶(E2)UbcH7发生特异性结合。而且,PknG同时具有非经典的泛素激活酶(E1)和泛素连接酶(E3)活性,并可利用其多种酶活性靶向调控宿主泛素系统,进而抑制宿主的固有免疫反应(图1)。

本文研究人员通过一系列生化、细胞及小鼠实验,从体外、体内两方面探索了Mtb的关键效应蛋白PknG对宿主固有免疫的调控作用。研究发现,Mtb感染过程中PknG被分泌到宿主细胞中,并通过其全新的Ubl(Ubiquitin-like)结构域与UbcH7结合,然后依次发挥非经典E1和异肽酶活性促进UbcH7-Ub复合物的形成及解离,进而获得活化的Ub;同时,PknG与肿瘤坏死因子受体相关因子2(TRAF2)和TGF-β激活激酶1(TAK1)结合,并将活化的Ub转移至TRAF2和TAK1上,从而介导它们的泛素化降解,最终抑制NF-κB信号通路的活化,促进Mtb的胞内存活(图1)。
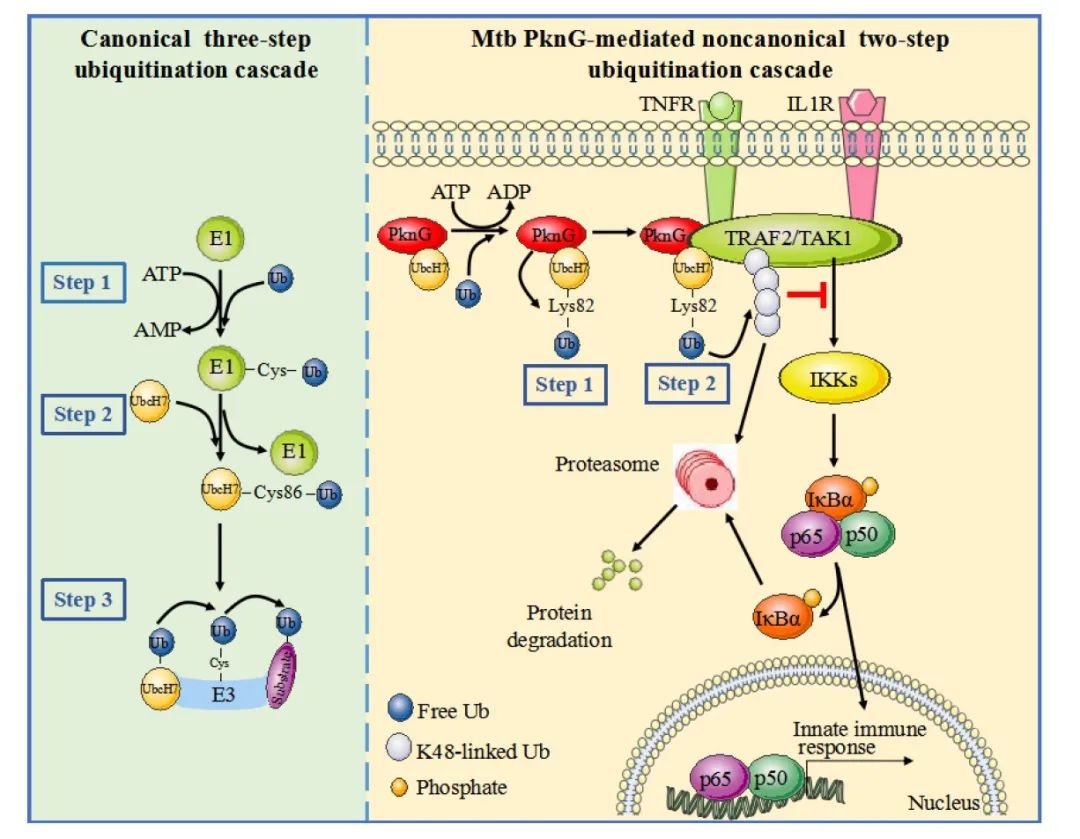
图1. Mtb PknG利用其非经典泛素化酶活性抑制宿主天然免疫反应的模式图
综上,本研究阐明了Mtb通过其效应蛋白PknG抑制宿主固有免疫的新机制,同时揭示了一种病原菌靶向宿主泛素系统的新策略,该研究也提示基于PknG非经典泛素化酶活性的抑制剂有望作为结核病治疗的潜在新药。
据悉,刘翠华课题组的项目研究员汪静、博士研究生葛浦浦和硕士研究生雷泽慧为该论文的共同第一作者,中国科学院微生物研究所刘翠华研究员、北京师范大学邱小波教授以及中国科学院微生物所高福院士为本文的共同通讯作者。
原文链接:
https://www.embopress.org/doi/full/10.15252/embr.202052175
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




