
大多数固体肿瘤对免疫疗法的低响应和耐药性仍然是该疗法面临的重大挑战。在免疫检查点阻断疗法难以治愈的癌症类型中,晚期前列腺癌尤其表现出对CTLA4抗体PD1抗体疗法的微弱响应,属于肿瘤免疫和前列腺癌领域的攻坚难题。在解决免疫疗法抗药性的方案中,使用靶向药物将免疫抑制性的冷肿瘤微环境转化为热肿瘤微环境、进而增强免疫检查点阻断疗效是很有希望的一种策略。前列腺癌被普遍认为属于冷肿瘤。理论上,造成冷肿瘤微环境有癌细胞内在和外在的原因,其中癌细胞固有的遗传改变和致癌途径可以引起肿瘤微环境的改变。但在前列腺癌细胞中,由于基因拷贝扩增引起的促癌基因激活如何造成免疫逃逸和免疫疗法耐受尚不清楚。显然,探明这方面的机理将为前列腺癌免疫治疗提供新思路。
美国圣母大学 (University of Notre Dame) 的Dr. Xin Lu副教授早在2018年就通过小鼠体内筛选首次将染色质效应子pygopus family PHD finger 2 (PYGO2) 鉴定为前列腺癌中1q21.3 扩增子编码的驱动致癌基因【1】。PYGO2在超过 50% 的原发灶和转移灶的去势抵抗性前列腺癌病例中发生拷贝数扩增,同时PYGO2的表达上调与高Gleason 评分、更短的无病生存期和更短的生化复发相关(1)。但迄今为止,对 PYGO2的研究主要集中在干细胞或者癌细胞的自主功能上,而对其在肿瘤免疫中的功能一无所知。
2023年3月10日,Dr. Lu课题组(第一作者博士研究生(已毕业)朱旖旎 (Yini Zhu) )经过全面的机理和前临床探究,在Science Immunology发表题为Targeting the chromatin effector Pygo2 promotes cytotoxic T cell responses and overcomes immunotherapy resistance in prostate cancer的研究论文【2】。在这项研究中,通过使用前列腺自发成瘤转基因小鼠模型、可在免疫完善小鼠中成瘤的前列腺癌细胞系模型、以及对病人样本的分析发现并确定了Pygo2在塑造前列腺癌的T细胞免疫逃逸中的不可或缺的作用。Pygo2通过上调Sp1/Kit/Ido1信号通路限制细胞毒性 T细胞在肿瘤内部的浸润并抑制其活性。重要的是,通过敲除Pygo2基因或小分子抑制Pygo2蛋白活性,小鼠的前列腺癌对一系列免疫治疗的响应都大幅度增加,在有些实验中Pygo2-免疫联合疗法甚至达到了100% 治愈小鼠前列腺癌的效果!这项基于前临床模型的基础研究表明,联合靶向Pygo2或有希望显著改善免疫疗法在晚期前列腺癌中的疗效。

首先,研究人员在小鼠的转移自发前列腺癌转基因模型PB-Cre4+ PtenL/L Smad4L/L和Nkx3.1CreERT2/+ PtenL/L Smad4L/L中进一步引入Pygo2L/L构建成Pygo2特异敲除的前列腺癌小鼠模型。Pygo2的敲除显著延缓了原发肿瘤的生长、抑制转移灶形成,并延长了小鼠的生存期 。通过使用质谱流式细胞术 (CyTOF) 对肿瘤中免疫细胞计数并用流式细胞术和免疫组化验证, Pygo2敲除的肿瘤中T细胞尤其是CD8 T 细胞的浸润显著增加。与自发性肿瘤一致,在同源肿瘤异体移植小鼠模型中,Pygo2敲除的肿瘤细胞系形成含有更多 CD8+和 CD4 + T 细胞以及更高的 CD8 + / Treg比例的肿瘤。一旦Pygo2表达恢复,T细胞浸入再次降低。研究人员通过进一步的体外癌细胞与特异性CD8 T细胞共培养以及体内清除CD8 T细胞等技术证明了Pygo2的促癌作用出乎意料地主要是通过限制效应 T 细胞浸润及其细胞杀伤力而实现的。有了有趣的表型,下一步是探明机理。
研究人员通过纯化DKO和TKO肿瘤中的EpCAM+ 癌上皮细胞,并进行RNA转录组分析找到了下游关键基因Kit (编码受体酪氨酸激酶c-Kit)。敲除与过表达等实验证明了Kit在Pygo2的下游、对Pygo2的促癌和抑制T细胞发挥决定性功能。并且Pygo2对Kit的调控不是通过常规的Wnt/β-catenin信号通路。为找到Pygo2如何调控Kit,研究人员通过一系列生物信息学手段以及p53基因特异性敲除模型发现了转录因子p53在Pygo2功能包括调控Kit中的重要作用。通过CUT&RUN-seq以及基因敲除、小分子抑制剂、单细胞测序等方式,最终确定了Pygo2通过p53/Sp1/Kit/Ido1信号通路营造了免疫抑制性的肿瘤代谢微环境,从而遏制T细胞在肿瘤中的浸润和杀癌活性。
为了验证靶向Pygo2对免疫治疗是否有积极影响,研究人员测试了Pygo2敲除以及免疫检查点抑制剂 (PD1 抗体加 CTLA4抗体) 、过继T 细胞疗法、CXCR2 抑制剂SX-682(可以阻断髓源性抑制细胞MDSC的肿瘤浸入)等一系列免疫治疗手段的单用和联用效果。结果显示,Pygo2敲除能让免疫治疗耐受的小鼠前列腺癌对免疫疗法异常敏感,尤其在RM9同源肿瘤异体移植模型中, Pygo2敲除加持下的免疫检查点抑制剂能达到100% 消灭肿瘤(图1A)。Ali 等人在2016年基于针对Pygo2 PHD 结构域的虚拟筛选找到了 Pygo2 小分子抑制剂JBC117 【3】。Dr. Lu团队合成JBC117并确认了它的抑制Pygo2的活性。在多个小鼠前列腺癌模型中,JBC117展现了协同免疫检查点抑制剂、强烈抑制肿瘤的能力(图1B)。除此之外,研究人员还设计了一套体外高通路筛选Pygo2小分子抑制剂的方法,为进一步筛选优化Pygo2抑制剂提供了技术手段。最后,研究人员通过对前列腺癌病人组织进行免疫荧光染色以及对接受免疫检查点抑制剂CTLA4抗体治疗的前列腺癌患者的生存和转录组数据分析,发现Pygo2 高表达与较低的 CTL 浸润和更差的预后相关(图1C)。
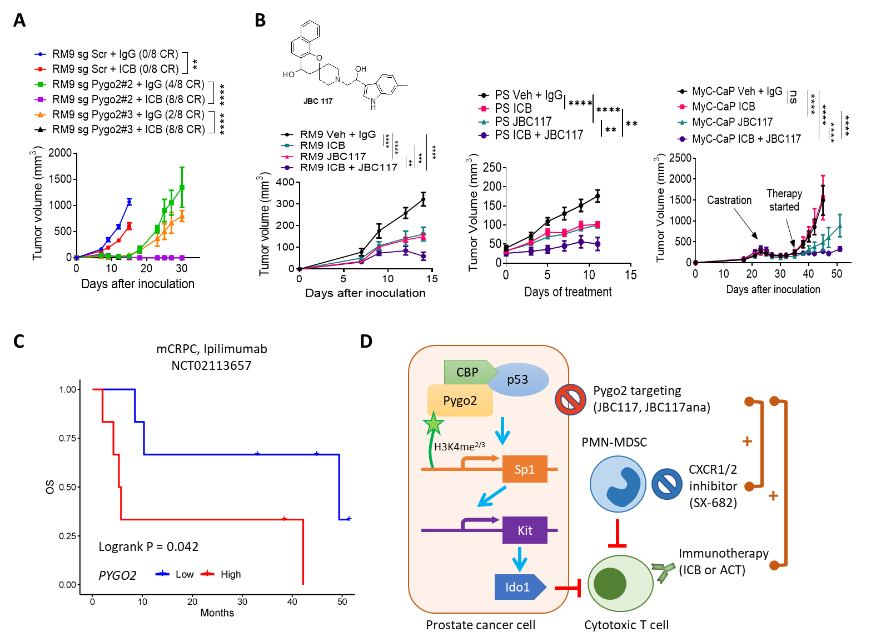
图 1. Pygo2 敲除或小分子抑制增强免疫治疗。(A) 接种 RM9 sgScr或 sgPygo2 亚系并用 IgG 或 ICB(PD1抗体 加CTLA4抗体)处理的肿瘤生长曲线。(B) JBC117 结构,以及单用和与ICB联用治疗三种前列腺癌的生长曲线。(C) 在ICB临床试验中PYGO2表达与患者生存的关联。(D) Pygo2 免疫调节功能和前列腺癌治疗机会的示意图。
总之,这项研究首次揭示了Pygo2在前列腺癌中如何启动涉及 p53、Sp1、Kit和 Ido1的信号通路,以减少瘤内T细胞的密度与活性,为Pygo2 抑制剂的临床开发提供了理论依据,也为增强免疫治疗在前列腺癌中的应用提供新的思路与动力(图1D)。

圣母大学生物系及综合生物医学系博士研究生(已毕业)朱旖旎为该论文唯一第一作者,Dr. Xin Lu副教授(Boler Associate Professor)为该论文通讯作者。感谢您的阅读与关注。Dr. Lu实验室目前有多个博士后和博士研究生的名额,启事如下,敬请申请。有意者可访问Lu实验室网页(https://biology.nd.edu/labs/lu-lab/) 并投递简历。

制版人:十一
参考文献




转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





