
责编 | 酶美
T淋巴细胞,又称T细胞,是获得性免疫系统的重要组成部分。T细胞依赖特殊的胸腺(thymus)微环境发育成熟,在胸腺中经历一系列分化发育后成为成熟的T细胞,随后迁移到外周淋巴组织器官中维持外周T细胞库的稳态。在胸腺内TCRβ重排完成后的CD4+ 和CD8+ 双阳性(Double Positive,DP)的T细胞进一步向单阳性的T细胞分化发育,最后经历由TCRβhiCD24+CD69+不成熟阶段向成熟的TCRβhiCD24-CD69-的过渡,同时上调Qa2表达的晚期发育过程,最终成为成熟的单阳性CD4+或CD8+ T细胞后获得迁移到外周的能力。精确调控这一发育分化过程的基因网络和相关机制仍然有待于进一步深入探索。
2021年4月16日,中国农业大学于舒洋课题组在Science Advances杂志上发表了题为 SRSF1 serves as a critical posttranscriptional regulator at the late stage of thymocyte development 的研究论文,揭示了SRSF1在胸腺T细胞晚期发育和成熟过程中的重要功能和相关机制,为T细胞发育转录后水平调控机制的解析提供了新的视角。

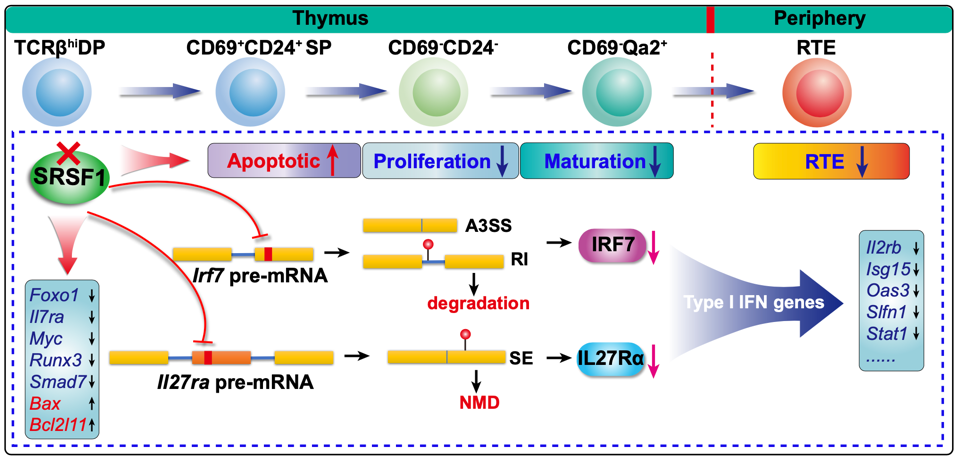
RNA结合蛋白SRSF1作为一个重要的剪切因子在pre-mRNA的剪切、mRNA稳定性、转录延伸和转录后翻译等重要的生物学过程中发挥重要的功能,但是其在胸腺细胞发育过程中的生物学功能尚不清楚。研究人员通过对Srsf1fl/flLckCre/+小鼠模型的系统分析,发现了在DP阶段特异性删除SRSF1的小鼠胸腺晚期发育异常,胸腺内TCRβhi胸腺细胞比例降低,成熟TCRβhiCD24-CD69-的CD4+或CD8+单阳性的T细胞显著减少,Qa2表达降低,晚期T细胞成熟受阻;并导致胸腺中新迁出至外周的T细胞减少,造成淋巴组织器官中T细胞数量和比例严重减少。机制分析表明SRSF1通过直接结合并调控一系列T细胞发育的重要相关基因的mRNA表达水平,维持胸腺细胞的分化、增殖和存活。其中一个主要机制是通过调控Irf7和Il27ra mRNA的可变剪切从而维持它们的表达水平,并直接影响了与之密切相关的I型干扰素应答的相关基因表达。而I型干扰素相关基因的表达下调对于维持TCRβhiCD24+CD69+阶段向终末成熟的TCRβhiCD24-CD69-单阳性T细胞转化和Qa2表达上调至关重要。综上,这项研究系统地阐明了RNA结合蛋白SRSF1在胸腺T细胞晚期发育中的重要功能,揭示了其通过调控I型干扰素相关基因的表达在单阳性T细胞终末成熟中的相关机制,为深入理解T细胞的晚期发育和成熟的转录后水平调控机制提供了新的切入点。
中国农业大学生物学院于舒洋教授为该论文的通讯作者;中国农业大学生物学院博士研究生齐志红、王芳、余国涛和中国科学院生物物理所博士研究生王迪为该论文的共同第一作者;中国科学院生物物理所的薛愿超研究员在RNA结合蛋白的实验设计和数据分析上提供了宝贵建议。

胸腺是T淋巴细胞(T lymphocyte)发育场所。来源于骨髓的造血祖细胞进入胸腺后,依次经历了CD4和CD8的双阴性(Double Negative,DN),双阳性(Double Positive,DP)和CD4或CD8单阳性(Single Positive,SP)阶段,发育形成一个能够识别各种不同外来抗原,同时对自身抗原耐受的T细胞库。新近产生的SP细胞从皮质迁入髓质,经历进一步表型演变,从TCRβhiCD24+CD69+不成熟阶段向TCRβhiCD24-CD69-成熟阶段转化,并上调Qa2的表达,最终迁出胸腺补充到外周T细胞库【1】。胸腺T细胞发育过程的每个阶段都受到了不同信号通路和相关转录因子的精密调控【2,3】。然而,人们迄今对晚期发育过程的调控机制仍缺乏充分认知。近年来,随着RNA生物学理论和技术进步,转录后调控在胸腺T细胞发育的作用收到越来越多的重视,成为领域内新兴的研究热点和重要方向。
中国农业大学于舒洋教授课题组近期在Science Advances杂志上发表论文,报道了RNA结合蛋白SRSF1在胸腺细胞的终末成熟过程中发挥着重要的功能。他们发现T细胞特异性SRSF1敲除导致晚期T细胞成熟受阻,胸腺内最为成熟的TCRβhiCD24-CD69-单阳性T细胞显著减少,并伴Qa2表达降低。与此一致,敲除小鼠外周淋巴组织中T细胞数量,尤其是新近迁出胸腺细胞 (Recent thymic emigrants, RET)数量显著减少,破坏了外周T细胞库的稳态。机制分析表明,RNA结合蛋白SRSF1通过调节Irf7 mRNA内含子5滞留的比例以及外显子6远端3’可变剪切位点使用频率从而维持正常剪切的Irf7转录本丰度。同时,SRSF1对促进Il27ra mRNA的外显子3剪切和拼接十分重要,从而维持IL27Rα蛋白的正常表达水平。研究系统阐明了SRSF1通过在转录后水平调节IRF7和IL27ra的表达促进胸腺T细胞终末成熟的相关机制。此外,该研究还拓展了人们对I型干扰素信号通路在诱导单阳性T细胞Qa2表达中的作用的认识,揭示SRSF1蛋白介导的转录后调控在终末分化胸腺T细胞对I型干扰素信号的响应中发挥重要功能。该研究开启了转录后调节事件参与T细胞晚期发育调控的新视角,同时也为I型干扰素在T细胞发育中的功能提供了新的数据支撑。
鲁林荣教授(浙江大学)
T细胞在胸腺中发育成熟,根据其表面CD4,CD8的表达可以分为双阴性(DN)、双阳性(DP)以及CD4+或CD8+单阳性 (SP) 阶段。这一发育分化的过程依赖于胸腺微环境及抗原的响应,和关键调控基因的精确表达调控。不过,以往的研究大多关注这一过程的转录调控,对转录后调控并没有太多的关注。
中国农业大学于舒洋课题组近期在Science Advances杂志上报道了富含丝氨酸/精氨酸的剪接因子1,即SRSF1 (serine/arginine-rich splicing factor 1) 在调控胸腺细胞晚期发育中的重要作用,提示了转录后调控在T细胞发育中的重要作用。作者首先利用了Lck-Cre在DP阶段将SRSF1基因敲除,发现这一阶段SRSF1的缺失导致胸腺中TCRβhi细胞数目大量减少,并且造成了TCRβhiCD24+CD69+未成熟胸腺细胞向TCRβhiCD24-CD69-成熟胸腺细胞发育的阻断。最终导致成熟T细胞向外周迁出减少。细胞水平的机制研究表明,SRSF1敲除导致TCRhi胸腺细胞增殖能力减弱以及凋亡增多。作者随后通过irCLIP实验分析了SRSF1结合的mRNA,并结合RNA-Seq等手段找到了SRSF1在胸腺细胞中的调控靶基因,发现其中一组I型干扰素相关基因是其主要靶基因,而生化实验证据表明,SRSF1可以直接调控IRF7和IL-27Rα mRNA的可变剪切及表达水平,因而决定I型干扰素相关基因的表达水平,确保晚期胸腺细胞发育进程。
之前报道显示SRSF1具有抑制T细胞活化,避免自身免疫性疾病发展以及作为系统性红斑狼疮的潜在治疗靶标等方面的作用【4】,本文首次报道了该基因在胸腺发育中的作用,更加完善了该转录后调控蛋白在T细胞中的作用。在机制研究中,虽然I型干扰素信号在T细胞发育中的功能已有提及【2,3】,但这些研究主要集中在转录调控机制的探究,没有关注转录后调控,也没有阐明在T细胞成熟过程中更为细致和具体的功能。该研究阐明了SRSF1通过直接结合并在转录后调控重要的I型干扰素因IRF7和IL-27Rα的可变剪切和表达量,从而通过影响I型干扰素信号的相关基因调控CD24+CD69+阳性的未成熟阶段向着CD24-CD69-成熟的单阳性T细胞分化,以及QA2的表达上调。综上,该研究对I型干扰素信号在胸腺细胞成熟过程中的作用提供了重要的相关机制,让我们对复杂的胸腺细胞发育调控有了更完整的了解。
总之,这项研究的创新点体现在从转录后调控的角度揭示了SRSF1在胸腺发育晚期的作用,给胸腺T细胞发育研究提供了一个新的视角。
余佳教授(医学科学院协和基础所)
RNA结合蛋白SRSF1(serine/arginine-rich splicing factor 1)是经典的富含丝氨酸/精氨酸的剪接因子,具有调控mRNA剪切和拼接,转录延伸以及稳定性的重要功能。SRSF1自1990年首次被纯化鉴定以来【5】,一直是RNA生物学领域内研究的前沿和热点。SRSF1表达异常已被证实与乳腺癌、肺癌、结肠癌、神经胶质瘤和白血病的发生发展密切相关【6-9】,是领域内公认的一个重要的原癌基因【10】。同时,SRSF1还陆续被发现在多种自免疫疾病、神经退行性疾病以及血管增生病中扮演着重要角色【4、11-13】。因此,SRSF1成为基础生物学和临床研究共同关心的热门分子。然而,SRSF1在免疫细胞发育和功能中的作用和相关调控机制却鲜有报道。
中国农业大学于舒洋课题组近期在Science Advances杂志上报道了SRSF1缺失会导致胸腺T细胞晚期发育的异常,阐明了SRSF1在转录后水平调控T细胞发育成熟的重要机制。研究人员通过分析在胸腺T细胞发育的CD4+CD8+双阳性(double positive, DP)阶段特异性缺失SRSF1的条件敲除小鼠模型,发现SRSF1对于维系在胸腺T细胞经历β-selection之后的存活、分化以及DP阶段和终末成熟的CD4+或CD8+单阳性T细胞的增殖至关重要。研究人员进一步通过CLIP-seq和RNA-seq等高通量测序结合生物信息学分析了SRSF1结合以及其缺失后表达异常,同时存在可变剪切异常的下游基因。发现SRSF1通过直接结合并调控IRF7和IL27Rα的mRNA的可变剪切来维持其功能转录本和蛋白的表达水平,进而维系着一系列重要的I型干扰素相关基因的表达。当SRSF1缺失时,IRF7和IL27Rα和I型干扰素相关基因表达水平显著降低,从而导致T细胞发育的终末成熟异常,TCRβhiCD24+CD69+未成熟胸腺细胞向TCRβhiCD24-CD69-成熟胸腺细胞发育的受阻,终末成熟的标志分子Qa2的表达显著下调,造成成熟的单阳性T细胞减少,新迁出至外周血、脾脏和淋巴结等外周淋巴组织和器官的T细胞减少,进而影响了外周T细胞库的更新和稳态。同时,研究人员还发现,SRSF1直接或者间接控制着与T细胞存活和增殖相关基因的表达,一旦SRSF1缺失,T细胞快速凋亡,不能长期存活。
综上,该研究阐明了RNA结合蛋白SRSF1在胸腺T细胞发育中的重要机制,不仅为T细胞发育的转录后调控增添了新的数据和理论,也为SRSF1表达异常与多种肿瘤和相关自免疫疾病的关联性提供了新的视角,SRSF1的缺失导致T细胞发育缺陷和数量剧减可能成为未来相关临床研究的一个重要切入点。
原文链接:
参考文献
1. Li, J., Li, Y., Yao, J.Y., Jin, R., Zhu, M.Z., Qian, X.P., Zhang, J., Fu, Y.X., Wu, L., Zhang, Y., et al. (2007). Developmental pathway of CD4+CD8- medullary thymocytes during mouse ontogeny and its defect in Aire-/- mice. Proc. Natl. Acad. Sci. U.S.A. 104, 18175-18180.
2. Metidji, A., Rieder, S.A., Glass, D.D., Cremer, I., Punkosdy, G.A., and Shevach, E.M. (2015). IFN-alpha/beta receptor signaling promotes regulatory T cell development and function under stress conditions. J. Immunol. 194, 4265-4276.
3. Xing, Y., Wang, X., Jameson, S.C., and Hogquist, K.A. (2016). Late stages of T cell maturation in the thymus involve NF-kappaB and tonic type I interferon signaling. Nat. Immunol. 17, 565-573.
4. Katsuyama, T., Li, H., Comte, D., Tsokos, G.C., and Moulton, V.R. (2019). Splicing factor SRSF1 controls T cell hyperactivity and systemic autoimmunity. J Clin Invest 129, 5411-5423
5. Krainer, A.R., Conway, G.C., and Kozak, D. (1990). Purification and characterization of pre-mRNA splicing factor SF2 from HeLa cells. Genes Dev 4, 1158-1171.
6. Anczukow, O., Akerman, M., Clery, A., Wu, J., Shen, C., Shirole, N.H., Raimer, A., Sun, S., Jensen, M.A., Hua, Y., et al. (2015). SRSF1-Regulated Alternative Splicing in Breast Cancer. Mol. Cell 60, 105-117.
7. Zhou, X., Wang, R., Li, X., Yu, L., Hua, D., Sun, C., Shi, C., Luo, W., Rao, C., Jiang, Z., et al. (2019). Splicing factor SRSF1 promotes gliomagenesis via oncogenic splice-switching of MYO1B. J. Clin. Invest. 129, 676-693.
8. Radzisheuskaya, A., Shliaha, P.V., Grinev, V., Lorenzini, E., Kovalchuk, S., Shlyueva, D., Gorshkov, V., Hendrickson, R.C., Jensen, O.N., and Helin, K. (2019). PRMT5 methylome profiling uncovers a direct link to splicing regulation in acute myeloid leukemia. Nat. Struct. Mol. Biol. 26, 999-1012.
9. Sinnakannu, J.R., Lee, K.L., Cheng, S., Li, J., Yu, M., Tan, S.P., Ong, C.C.H., Li, H., Than, H., Anczukow-Camarda, O., et al. (2020). SRSF1 mediates cytokine-induced impaired imatinib sensitivity in chronic myeloid leukemia. Leukemia 34, 1787-1798.
10. Karni R, de Stanchina E, Lowe SW, Sinha R, Mu D, Krainer AR. The gene encoding the splicing factor SF2/ASF is a proto-oncogene. Nat Struct Mol Biol. 2007 Mar;14(3):185-93.
11.Paz, S., Ritchie, A., Mauer, C., and Caputi, M. (2021). The RNA binding protein SRSF1 is a master switch of gene expression and regulation in the immune system. Cytokine Growth Factor Rev 57, 19-26.
12.Hautbergue, G.M., Castelli, L.M., Ferraiuolo, L., Sanchez-Martinez, A., Cooper-Knock, J., Higginbottom, A., Lin, Y.H., Bauer, C.S., Dodd, J.E., Myszczynska, M.A., et al. (2017). SRSF1-dependent nuclear export inhibition of C9ORF72 repeat transcripts prevents neurodegeneration and associated motor deficits. Nat Commun 8, 16063.
13.Xie, N., Chen, M., Dai, R., Zhang, Y., Zhao, H., Song, Z., Zhang, L., Li, Z., Feng, Y., Gao, H., et al. (2017). SRSF1 promotes vascular smooth muscle cell proliferation through a Delta133p53/EGR1/KLF5 pathway. Nat Commun 8, 16016.
(可上下滑动阅览)
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




