截至2021年9月26日,SARS-CoV-2已经在全球导致了超过2.3亿COVID-19确诊病例,其中包括了多达475.1万的死亡病例。尽管我国已经全面控制了新冠疫情的大面积传播,然而仍有一些输入病例和零星本土病例偶现。开发强效地针对新冠病毒的疫苗成为了当前疫情防控的当务之急。
目前全世界有超过两百款备选疫苗处于研发当中,我国已有22个新冠疫苗进入临床试验阶段。在COVID-19爆发初期,新冠疫苗研发多集中于技术路线相对成熟的灭活疫苗、核酸疫苗和腺病毒疫苗。亚单位疫苗因需要探索有效可行的免疫原,因此早期相对缓慢,但由于亚单位疫苗的工艺相对简单且效价和安全性更高,近期已经成为全世界进一步研发特效疫苗的主流方向,已经有多达80款重组亚单位疫苗处于临床前和临床研究当中。
中山大学人类病毒学研究所张辉教授课题组从事新型纳米颗粒疫苗研究,与以往技术路线非常成熟的灭活疫苗、减毒疫苗和腺病毒疫苗不同的是,纳米颗粒疫苗是多抗原重组蛋白疫苗,可以实现在单个纳米疫苗表面同时展示24个相同或不同的新冠病毒抗原。
2020年11月25日,中山大学团队在Cell 子刊 Immunity 在线发表了题为Nanoparticle Vaccines Based on the Receptor Binding Domain (RBD) and Heptad Repeat (HR) of SARS-CoV-2 Elicit Robust Protective Immune Responses的研究论文。
张辉团队对经过纳米颗粒疫苗免疫过的人源化鼠模型上进行了野生型SARS-CoV-2的呼吸道感染,发现未经免疫的小鼠肺部损伤严重,病毒复制迅速,并且部分小鼠在感染三天后相继死亡。而经过纳米颗粒疫苗免疫过的小鼠健康状况良好,肺部无损伤,在包括肺在内的11个脏器组织中均检测不到残留病毒。可见,纳米颗粒疫苗诱导的中和抗体可以显著地抵御机体免遭新冠病毒感染Cell子刊Immunity。在安全性方面,中山大学研发的纳米颗粒疫苗具有比较高的安全性。实验结果表明纳米颗粒疫苗没有引起小鼠其他脏器损伤等副作用,团队同时检测了小鼠诱导产生的抗体是否可能引起抗体依赖的感染增强作用(ADE),结果发现纳米颗粒疫苗诱导的抗体均无ADE作用。
在初始免疫原筛选过程中,张辉教授团队充分考虑到了单次免疫单体抗原可能引起的免疫原性不足,以及辅助性T细胞(Tfh)与生发中心B细胞(GC B)可能存在协同效应低下。团队将Ferritin的纳米颗粒展示技术应用到新冠疫苗的研发当中,利用Ferritin自组装成24聚体的能力,将RBD抗原密集地展示于纳米颗粒的表面。同时为了充分调动T细胞协同免疫,团队将富含T细胞表位的HR抗原也引入到纳米颗粒疫苗表面,通过SpyTag/SpyCatcher(ST/SC)系统将RBD和HR双抗原共同展示在纳米颗粒表面(图1C)。Ferritin通过细菌系统表达,RBD和HR通过真核CHO-S系统表达,使用Ni Sepharose excel(Cytiva)进行纯化。随后将不同比例的RBD和HR与Ferritin共孵育,在普通缓冲液环境下迅速组装形成含有RBD或RBD/HR的纳米颗粒。再通过Superose 6 Increase 10/300 GL分子筛(Cytiva)纯化和超滤浓缩,最终产生纳米颗粒疫苗(图1B)。只含SC-Ferritin的纳米颗粒在12-15mL出峰;RBD-Ferritin纳米颗粒在11-14mL出峰;RBD/HR-Ferritin纳米颗粒在8-13mL出峰(图1E)。纳米颗粒通过Western blotting、分子筛(SEC)、透射电镜(TEM)进行纯度和均一性的验证。

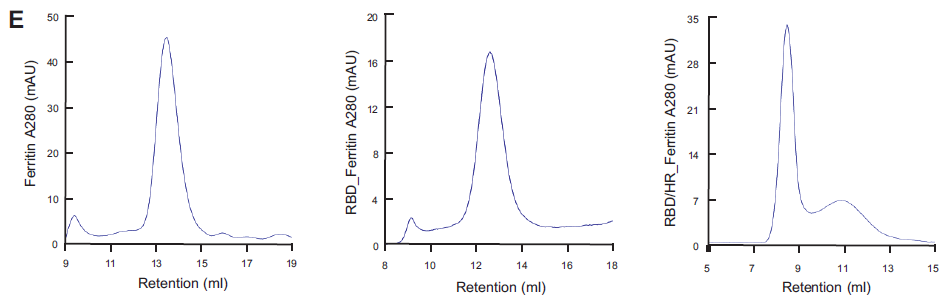
图1 纳米颗粒疫苗的构建与纯化
随后,作者测试了纳米颗粒疫苗体液免疫响应。相较蛋白疫苗,这两种纳米疫苗免疫BALB/c小鼠后产生更强的B细胞免疫响应,特异性抗体水平高2个数量级左右。由于SARS-CoV-2通过RBD结合hACE2识别和进入目的细胞,作者随后利用Biacore研究了纳米颗粒的偶联是否影响RBD与hACE2的结合。具体的Biacore实验由张选红老师在中山大学医学院平台使用Biacore T100完成。使用CM5芯片偶联hACE2(2 μg/mL, in 10mM acetate buffer, pH 4.5)。只含Ferritin的纳米颗粒(阴性对照),RBD单体(阳性对照),RBD-Ferritin纳米颗粒和RBD-HR-Ferritin纳米颗粒稀释成不同的浓度梯度进样(30 μL/min)120s,解离200s。Biacore结果显示,RBD-Ferritin和RBD-HR-Ferritin纳米颗粒对hACE2的结合在同一数量级。之后,作者使用Flow cytometry进行血清抑制实验,FRNT细胞实验进行中和实验,进一步研究了纳米颗粒疫苗体液免疫反应。

图2 Biacore测试不同纳米颗粒与RBD单体对hACE2的结合
接下来,作者使用ELISpot(enzyme-linked immune absorbent spot)与ICCS(intracellular cytokine staining)assays测试了纳米颗粒疫苗T细胞免疫响应。相较蛋白疫苗,这两种纳米疫苗免疫BALB/c小鼠后产生更强的T细胞免疫响应,且主要是Th1的免疫响应,Th2免疫响应则无明显差异(IL-4水平相当),表明纳米颗粒疫苗不会产生疫苗相关的呼吸疾病增强作用。对于树突细胞、巨噬细胞的分析表明,这两种纳米疫苗可以促发更有效的抗原递呈过程。基于人PBMC的ex vivo试验得到类似的结果,纳米颗粒疫苗诱导更强的T细胞和B细胞免疫响应。
研究者还发现,经纳米颗粒疫苗免疫后的血清不会通过FcγR受体增强靶细胞的感染,即不存在抗体介导的感染增强作用(ADE)。阳性对照组血清即经过ZIKV感染的动物血清则表现出明显的感染增强现象。最后,该研究还系统分析了经纳米颗粒疫苗免疫的小鼠模型10余个脏器组织的病变损伤情况,以及恒河猴免疫前1周至免疫后12周的体温、体重、血常规和尿常规等生理生化指标变化(图3)。发现经纳米颗粒疫苗免疫的动物个体脏器均正常,各项指标均在正常范围内波动,为深入的临床实践提供了宝贵的研究基础。

图3 纳米颗粒疫苗制备与动物免疫模型
在整篇文章中,ÄKTA 辅以Ni Sepharose excel,Superose 6 Increase 10/300 GL分子筛,助力纳米颗粒疫苗的制备与质控,Biacore助力纳米颗粒疫苗分子水平的结合活性分析,结合一系列的细胞、动物实验,最终探索开发了一款针对新冠病毒的新型双抗原纳米颗粒疫苗。该纳米颗粒疫苗的中和抗体效价、T/B细胞协同免疫反应和交叉保护作用,均显著高于亚单位单体疫苗,极大地拓展了当前疫苗研发技术路线。深入探究纳米颗粒疫苗发挥作用的机制以及开展临床前安全评估工作将为该疫苗推向市场提供更加强有力的保障。
图4 文章整体思路回顾
2021年8月,张辉教授团队再接再厉,在 Nature 子刊 Cellular & Molecular Immunology上再发文章,对纳米颗粒疫苗递送载体中关键“连接元件”进行筛选与优化,使用GvTagOpti/SdCatcher(Gv/Sd)系统替代行业惯用的SpyTag/SpyCatcher(ST/SC)系统(图1A,C),并用Biacore比较了Gv/Sd与ST/SC的差异,相关实验由张选红老师在中山大学医学院平台使用Biacore T100完成。将重组SdCatcher-Ferritin与SpyCatcher-Ferritin通过氨基偶联分别固定于CM5芯片。用HEPS buffer分别对半稀释GvTagOpti-RBD与SpyTag-RBD浓度梯度(0.1875 - 6 μM)进行进样。结果显示GvTagOpti-RBD对SdCatcher-Ferritin的亲和力比SpyTag-RBD对SpyCatcher-Ferritin的亲和力提升了3倍(图5)。从各种细菌中筛选优化得到的具有完全自主知识产权的天然蛋白异肽键“连接元件”既增强抗原呈递,又适用于产业化生产,克服了国际行业卡脖子难题。
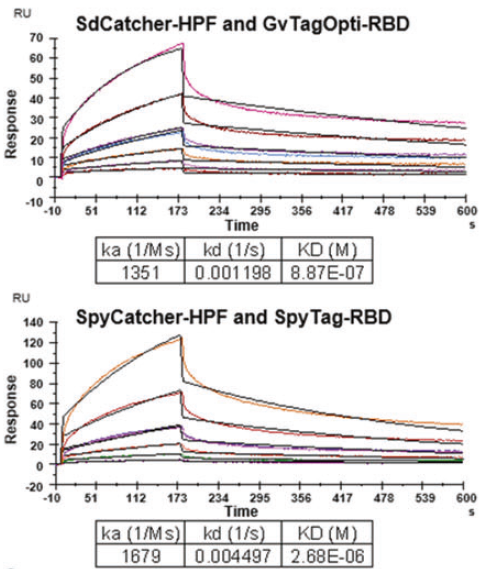
图5 Biacore测试GvTagOpti/SdCatcher系统与SpyTag/SpyCatcher体统的差异
福利来啦!
本研究所用AKTA和Biacore仪器均为Cytiva公司产品,为此Cytiva诚邀您填写调研问卷(识别二维码即可填写)获取《Biacore芯片与耗材选择指南》,还能赢好礼!
我们将从中抽取30名送出Cytiva定制SWISSGEAR双肩包。中奖结果将在29日在本文评论区公布。



参考文献:
中山大学人类病毒学研究所
Nanoparticle Vaccines Based on the Receptor Binding Domain (RBD) and Heptad Repeat (HR) of SARS-CoV-2 Elicit Robust Protective Immune Responses
Immunity. 2020 Dec 15;53(6):1315-1330.e9.
Improvement of a SARS-CoV-2 vaccine by enhancing the conjugation efficiency of the immunogen to self-assembled nanoparticles
Cell Mol Immunol. 2021 Aug;18(8):2042-2044.
更多Biacore助力新冠疫苗研发的文章请参考扩展阅读:(上下滑动查看)



 个人中心
个人中心
 我是园区
我是园区





