
1
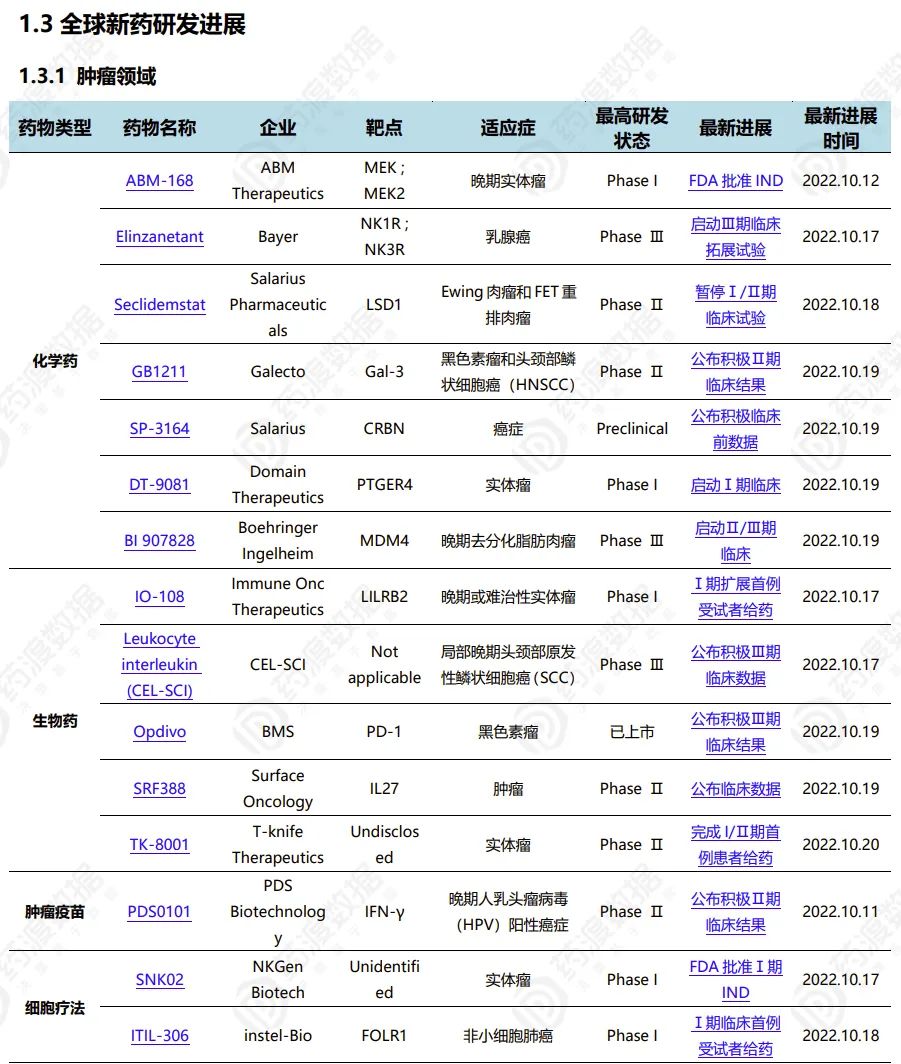
2022.10.15-10.21这一周,全球新药研发各个领域均有新的突破,包括:肿瘤、精神、神经、消化系统、心血管、感染、免疫、皮肤和结缔组织疾病、内分泌系统等多个领域。其中,肿瘤等热门领域依旧同时涵盖了化学药、生物药、细胞疗法的最新研究进展。
拜尔启动Elinzanetant拓展适应症的III期临床研究
Elinzanetant是一种一流的非激素口服双神经激肽-1,3受体拮抗剂,目前正在临床开发中,用于治疗绝经期间的血管舒缩症状。Elinzanetant通过调节大脑下丘脑中的一组雌激素敏感神经元(KNDy神经元)来解决血管舒缩症状,由于雌激素的缺乏,这些神经元在更年期妇女中变得过度活跃,从而破坏体温控制机制,导致潮热的血管舒缩症状。
与助产剂OASIS的临床III期开发计划目前包括四项III期研究:OASIS 1,2,3和4。
III期临床开发计划的设计和剂量基于两项II期研究(RELENT-1和SWITCH-1)的阳性数据。RELENT-1是一项Ib /IIa期研究,旨在调查Elinzanetant的安全性,药代动力学和初步疗效。SWITCH-1是一项IIb期研究,研究了与安慰剂相比,四种不同剂量的Elinzanetant在血管舒缩症状患者中的疗效和安全性。
血管舒缩症状(VMS,也称为潮热)是由克尼迪神经元因停用雌二醇而引起的KNDy神经元肥大介导的体温调节途径过度激活的结果,这可能是由于自然绝经或双侧卵巢切除术或内分泌治疗引起的卵巢功能逐渐减少。
在更年期过渡期间的某个时候,高达80%的女性报告了VMS(潮热),这是在女性生命这一特定阶段寻求医疗护理的主要原因。超过1/3的女性报告严重症状,在最后一次月经后可持续10年或更长时间。血管舒缩症状可能对睡眠、情绪和生活质量产生负面影响。
内分泌治疗引起的血管舒缩症状会影响生活质量和治疗依从性,目前无法解决,因为没有可用的治疗方案。
CinCor Pharma宣布Baxdrostat I期临床多剂量递增研究结果在日本Hypertension Research期刊发表
更多具体信息,请联系小编获取
2
2022年10月15日-10月21日,国内新药研发同样突飞猛进,治疗肿瘤的生物药进展迅速。
开拓药业福瑞他恩治疗痤疮中国II期临床试验完成患者入组
该项II期临床试验是一项多中心、随机、双盲、安慰剂对照的研究,目的是评估福瑞他恩(凝胶)在轻中度痤疮患者中外用给药后的安全性和有效性。该试验的主要终点为治疗12周时,各组患者的治疗成功率(根据研究者整体评估(IGA)5分量表,把IGA评分下降到0-1且下降等级≥2级的受试者记为“成功”)。
关于痤疮
痤疮是世界第八大流行疾病,多发于青春期并主要累及面部。全球痤疮患者人数已超过7.4亿。痤疮发病机制复杂,雄激素及其受体信号通路对皮脂腺及皮脂分泌的影响是引起痤疮的重要因素之一。2020年8月,美国FDA批准首款雄激素受体(AR)拮抗剂用于痤疮的治疗,这是FDA过去40年以来批准的首款痤疮药物,也证明AR作用机制治疗痤疮受到监管的认可。国内目前尚无雄激素受体抑制剂获批用于痤疮的治疗,迫切需要安全有效的药物来满足巨大的临床需求。
关于福瑞他恩
福瑞他恩是一种AR拮抗剂,是用于治疗雄激素性脱发和痤疮的潜在同类首创外用药物。针对痤疮适应症,作为靶点明确的外用AR拮抗剂,福瑞他恩通过涂抹给药的作用方式,可抑制毛囊皮脂腺中的雄激素受体与雄激素的结合,从而减少皮脂产生,实现痤疮的治疗。针对雄激素性脱发适应症,开拓药业正在中国进行治疗男性雄激素性脱发III期临床试验和在美国进行II期临床试验,针对女性雄激素性脱发正在中国进行II期临床试验。

亚盛医药将在美国肝病学会年会以口头报告的形式公布IAP拮抗剂APG-1387治疗慢性乙型肝炎的临床进展
2022年10月20日,亚盛医药宣布,公司将在第73届美国肝病研究学会年会(AASLD 2022)上以口头报告形式公布其在研凋亡蛋白抑制因子(IAP)拮抗剂APG-1387治疗慢性乙型肝炎(CHB)的首次人体I期试验的研究成果。本项临床试验的主要研究者是南方医科大学南方医院肝病中心主任、肝病研究所所长侯金林教授。
这是全球层面IAP靶点拮抗剂在CHB领域的临床探索结果的首次公布,并呈现初步的有效性和安全性。通过拮抗IAP靶点诱导乙肝病毒感染的肝细胞产生凋亡以及免疫调控机制,有可能成为功能性治愈乙肝的一种革命性方法。
AASLD年会是全球肝病领域最具影响力的医学会议之一,本届会议将于当地时间11月4日至8日在美国华盛顿以"线上+线下"相结合的方式召开。
标题:凋亡蛋白抑制因子拮抗剂APG-1387治疗慢性乙型肝炎的首次人体试验
摘要编号:32
分会场标题:分会2-旨在功能性治愈乙型肝炎及丙型肝炎的新型疗法/ Parallel 2: Novel Therapeutic Approaches Aimed at Functional Cure of Hepatitis B and D
报告时间:美国东部时间 2022年11月6日(周日) 9:00-10:30 AM
报告场地:沃尔特.华盛顿会议中心 - Room 14
 来源:PRNewswire
来源:PRNewswire
2022.10.15-10.21国内新药研发进展(部分)
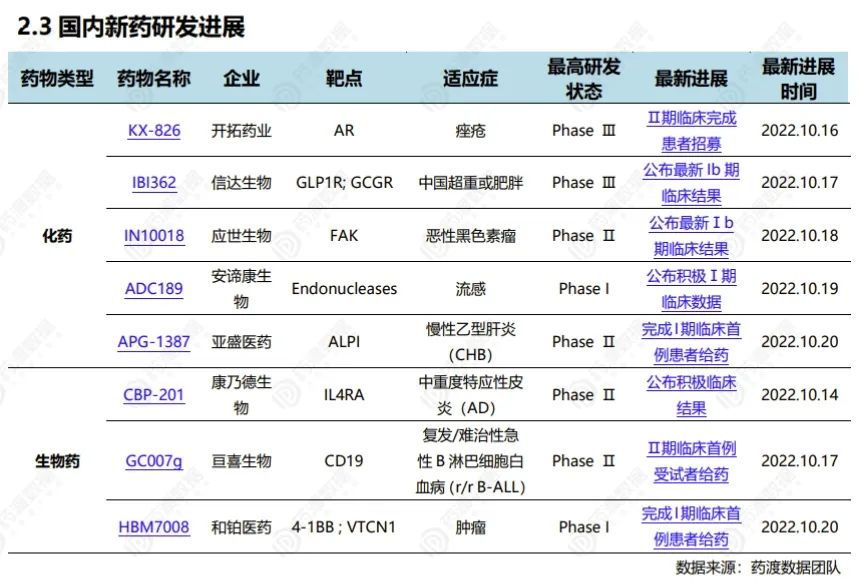
更多具体信息,请联系小编获取
3
2022.10.15-10.21临床默示许可进展(部分)
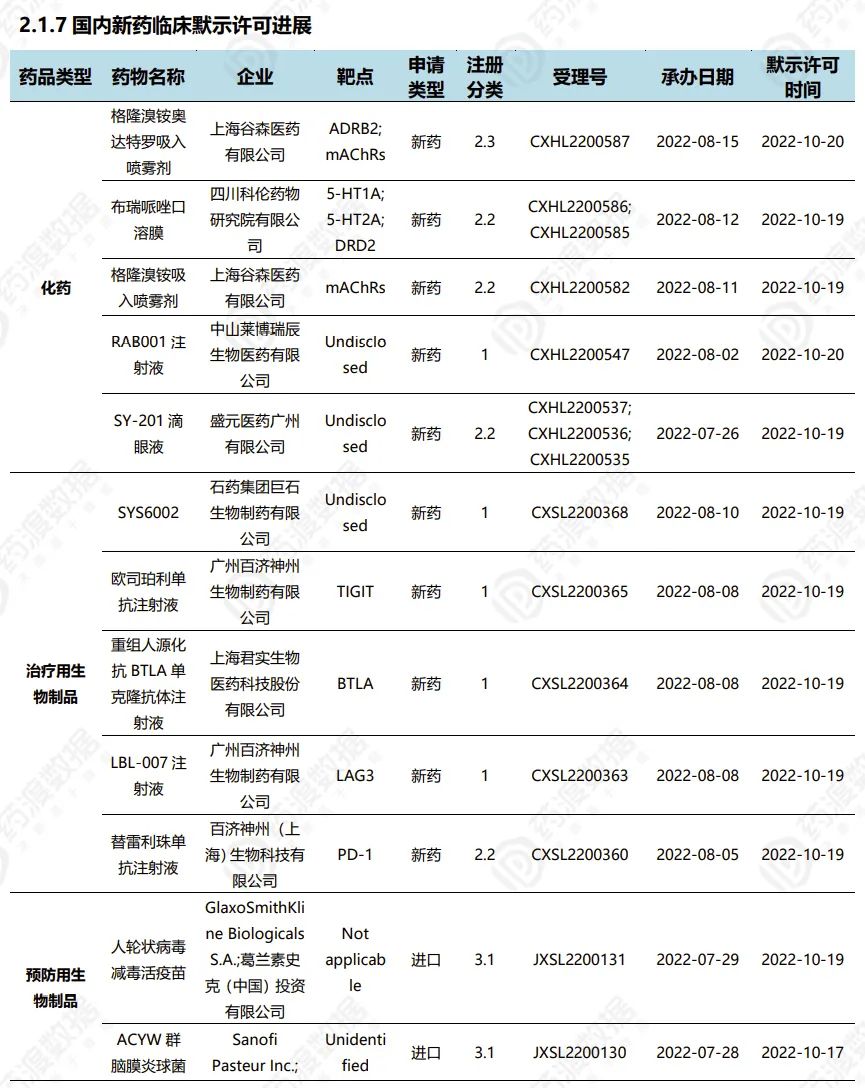
4
全球医药交易事件
安斯泰来和Pantherna签订新技术评估协议,应用拓展靶器官研究以直接重编程开发基于mRNA技术的再生医学项目

祐和医药与美国Syncromune公司就OX40单抗(YH002)等达成全球授权协议,共同开发瘤内免疫疗法
YH002是一种重组人源化IgG1单克隆抗体,它特异性靶向于人类肿瘤坏死因子受体超家族成员4(TNFRSF4,OX40),从而诱导多效的下游抗癌活性。该抗体正在开发用于治疗晚期/转移性实体瘤。YH002通过刺激效应T细胞和抑制或耗竭调节性T细胞(Treg细胞)克服免疫抑制来提高抗肿瘤活性。在临床前研究中,YH002表现出了优异的特异性、亲和力和安全性,在百奥赛图人源化小鼠药效动物模型中亦表现出了很好的的成药性及联合用药的巨大潜力。正在进行的多中心、开放标签的I期剂量爬坡研究,旨在评估YH002联合疗法在晚期实体瘤患者中的安全性、耐受性和药代动力学。

2022.10.15-10.21全球医药交易(部分)
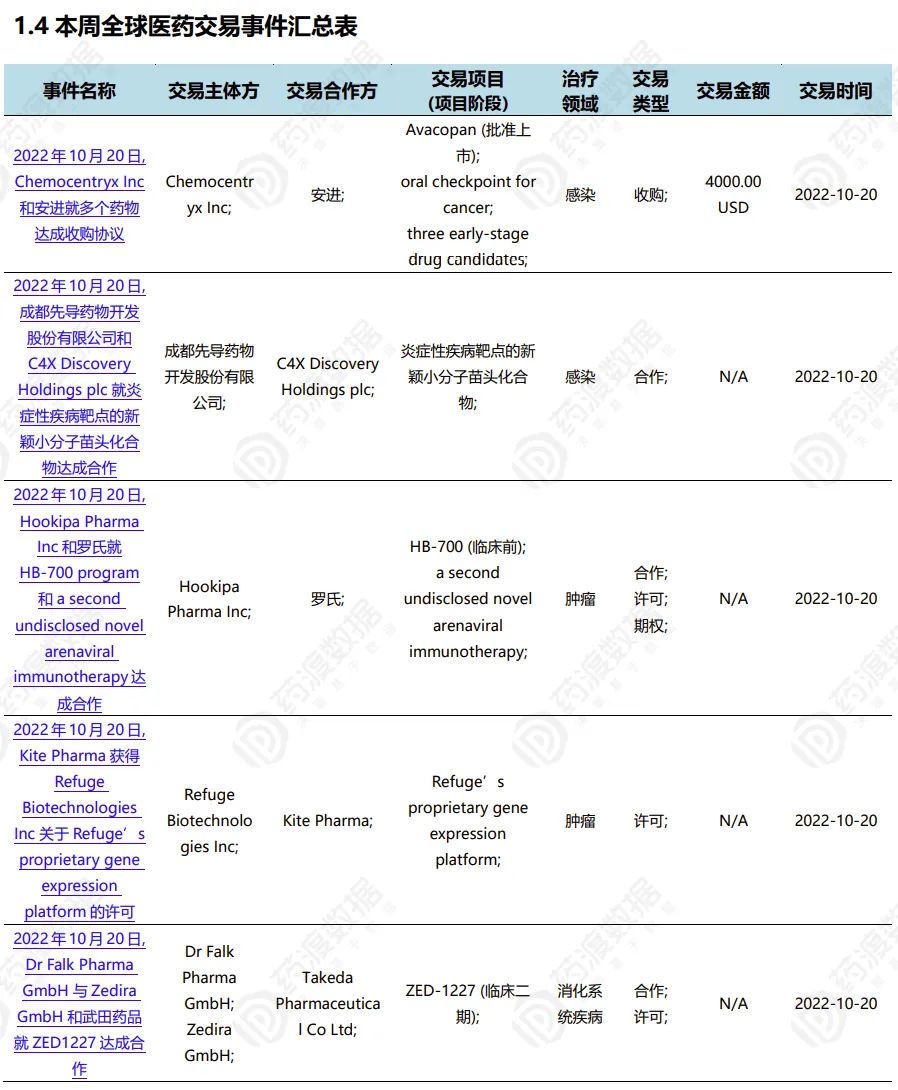
声明:本公众号发布的各类文章重在分享资讯、传播知识和普及科学。文章不构成任何投资建议,也非治疗方案建议。


点击"阅读原文",随时掌握行业动态



 个人中心
个人中心
 我是园区
我是园区





