
责编 | 兮
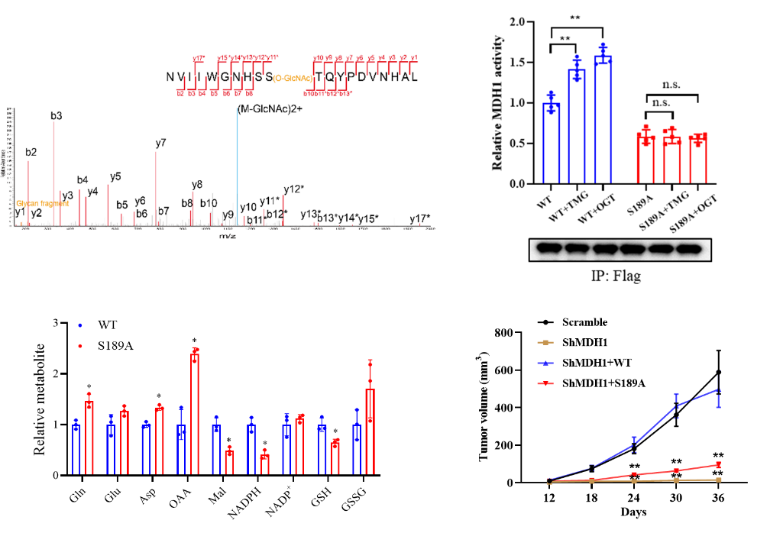
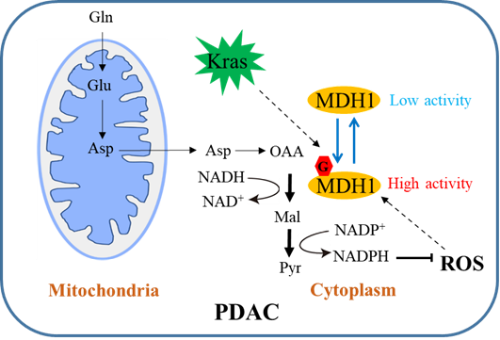
胰腺癌是一种恶性程度极高的消化系统肿瘤,确诊后患者的五年生存率仅为10%左右。代谢的改变是肿瘤细胞的重要特征之一。肿瘤细胞通过代谢重编程产生其快速增殖所需的物质、能量以及氧化还原力。癌基因Kras突变的胰腺导管腺癌(PDAC,胰腺癌中最常见的病理类型)的增殖高度依赖谷氨酰胺(Gln)分解代谢途径【1】。在该途径中,Gln首先被转化成天冬氨酸(Asp),随后在谷草转氨酶(GOT1)催化下形成草酰乙酸(OAA),OAA经苹果酸脱氢酶(MDH1)催化进一步被转化为苹果酸(Malate),再经苹果酸酶(ME1)氧化最终形成丙酮酸(Pyruvate)和NADPH;后者能提供还原当量,维持细胞内氧化还原平衡。该途径对于PDAC细胞的增殖和存活至关重要,因此深入了解这一途径的调控机制有助于为PDAC的临床治疗提供新的思路和靶点。
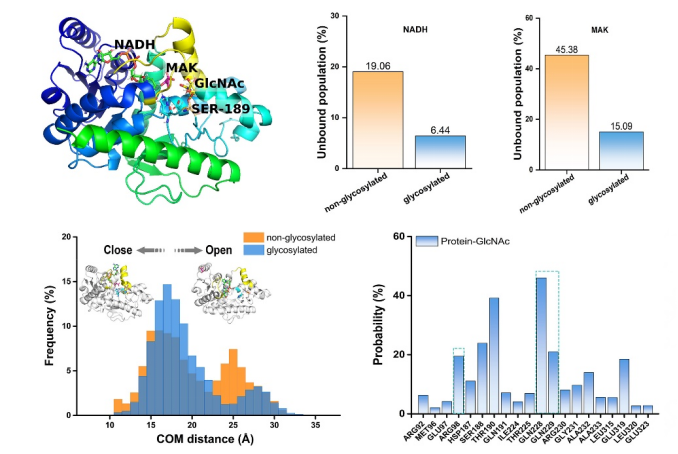
O-GlcNAc糖基化修饰是通过N-乙酰葡糖胺以β-糖苷键形式共价连接到蛋白质的丝氨酸(Ser)或苏氨酸(Thr)羟基上的一种翻译后修饰【2】。该修饰是一种高度动态的修饰方式,会随着细胞内的营养状态和细胞外的刺激发生变化。该修饰广泛发生在细胞内的蛋白上,并调控基因转录、信号传导、蛋白合成和代谢重编程等重要的生物学过程【2】。之前的研究表明O-GlcNAc糖基化修饰水平在PDAC中异常增高【3】。然而O-GlcNAc糖基化调控PDAC发生发展的分子机制尚不清楚。
2022年7月25日,浙江大学生命科学学院易文教授课题组和周如鸿教授课题组合作在Nature Chemical Biology杂志上在线发表了题为“O-GlcNAcylation promotes pancreatic tumor growth by regulating malate dehydrogenase 1”的研究论文【4】,通过糖化学生物学、肿瘤生物学和计算生物学多学科交叉手段,揭示了O-GlcNAc糖基化调控谷氨酰胺代谢,促进PDAC生长的分子机制。

参考文献
1.Son, J., et al. Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway. Nature 496, 101-105 (2013).
2.Slawson, C. & Hart, G.W. O-GlcNAc signalling: implications for cancer cell biology. Nat Rev Cancer 11, 678-684 (2011).
3.Qian, K., et al. Transcriptional regulation of O-GlcNAc homeostasis is disrupted in pancreatic cancer. J Biol Chem 293, 13989-14000 (2018).
4.Zhu, Q., et al. O-GlcNAcylation promotes pancreatic tumor growth by regulating malate dehydrogenase 1. Nat Chem Biol. doi: 10.1038/s41589-022-01085-5 (2022).

转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




