▎药明康德内容团队报道
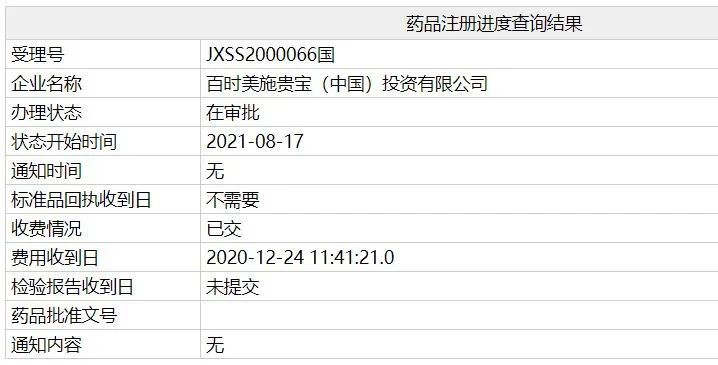
中国国家药监局(NMPA)公示显示,百时美施贵宝公司(BMS)纳武利尤单抗注射液(欧狄沃)的新适应症上市申请的办理状态已更新为“在审批”,这意味着该药有望于近期在中国迎来新的适应症。此前,纳武利尤单抗已在中国获批4项适应症。
纳武利尤单抗是BMS开发的一款PD-1免疫检查点抑制剂,其作用机制是利用人体自身的免疫系统来帮助机体恢复抗肿瘤免疫反应,这种特性已使其成为了多种肿瘤的重要治疗选择。
自2014年7月获批以来,纳武利尤单抗已在60多个国家和地区获批治疗十余个癌种,涵盖肺癌、头颈癌、胃癌、食管癌、肝癌、肾癌、结直肠癌、尿路上皮癌、黑色素瘤、霍奇金淋巴瘤、胸膜肿瘤等。
就在
昨日(
8月20日
),BMS
刚刚
宣布一项新
进展
,美国
FD
A
已经批准
纳武利尤单抗的又一适应症,用于尿路上皮癌的辅助治疗。
在中国,纳武利尤单抗于2018年首次获批上市。截止目前,该药已在中国获批四个适应症,分别为:
用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者;
用于接受含铂类方案治疗期间或之后出现疾病进展、且肿瘤PD-L1表达阳性(表达PD-L1的肿瘤细胞≥1%)的复发性或转移性头颈部鳞状细胞癌患者;
用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管连接部腺癌患者;
联合伊匹木单抗注射液用于不可手术切除的、初治的非上皮样恶性胸膜间皮瘤成人患者。
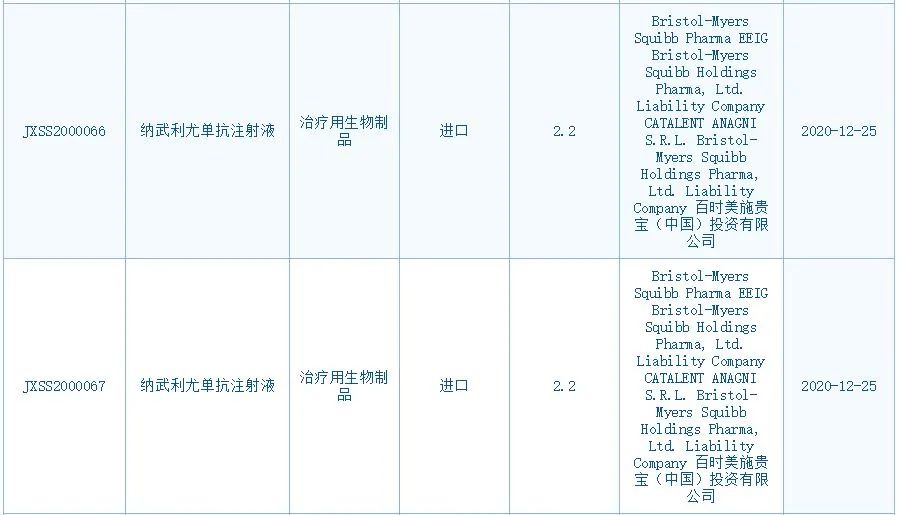
2020年12月,纳武利尤单抗注射液的两项新适应症上市申请获得中国国家药监局药品审评中心(CDE)受理。本次,这两项上市申请进入“在审批”则意味着,纳武利尤单抗这款创新疗法有望惠及更多的中国患者。
根据中国药物临床试验登记与信息公示平台,目前纳武利尤单抗注射液还在中国开展多项临床研究,涉及的适应症包括中期肝癌、雌激素受体阳性(ER+)/人表皮生长因子受体2阴性(HER2-)原发性乳腺癌、可切除的II-IIIB期非小细胞肺癌、男性转移性去势抵抗性前列腺癌、晚期肝细胞癌、复发性或转移性结直肠癌等等。其中,纳武利尤单抗针对中期肝癌、ER+/HER2-原发性乳腺癌、II-IIIB期非小细胞肺癌、晚期肝细胞癌的多项研究均处于3期临床研究阶段。
期待纳武利尤单抗的新适应症上市申请早日获批,为患者带来更多的治疗选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局药品注册进度查询. Retrieved Aug 20,2021, from http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?tableId=43&tableName=TABLE43&columnName=COLUMN464,COLUMN475&title=%D2%A9%C6%B7%D7%A2%B2%E1%BD%F8%B6%C8%B2%E9%D1%AF
[2] 全球首个双免疫治疗在华获批!“免疫双子星”用于恶性胸膜间皮瘤一线治疗. Retrieved June 11,2021, from https://mp.weixin.qq.com/s/bdsqkW-DJSiJwl8sp1iMUA
声明:本文来自药明康德内容团队,欢迎个人转发至朋友圈。转载授权请在「医药观澜」微信公众号留言联系我们。







 个人中心
个人中心
 我是园区
我是园区




