Cell | 程赛凤等揭示DNA去甲基化酶TET在小鼠原肠胚发育过程中的细胞自主性和非自主性功能
收藏
关键词:
Cell细胞DNA揭示
资讯来源:BioArt + 订阅账号
发布时间:
2022-08-01

多细胞生物体内具有相同基因组的细胞如何分化出不同的形态和功能是生物学领域一个基本的研究问题。小鼠早期胚胎发育是研究细胞命运决定的重要模式系统之一。在早期胚胎发育过程中,高度特化的精细胞与卵细胞结合形成单细胞受精卵,通过快速的细胞分裂与分化,最终经由原肠运动
(gastrulation)
形成了具有外、中、内三个胚层的多细胞个体。
近年来,单细胞时间和空间转录组技术的发展极大地推动了胚胎发育过程中不同胚层谱系发生过程的解析
【1-4】
。这些研究集中于发现和鉴别小鼠胚胎发育过程中的细胞类型或者细胞状态
(cell types/cell states)
及其组成。对于调控不同细胞状态的基因功能研究则相对较少。即便将单细胞测序技术与其他技术
(例如基因编辑等)
相结合,很多基因功能的研究依然具有一定程度的描述性质,且没有将基因功能在组织水平上的效应和单细胞水平上的响应作出明显区分。
原肠胚是由高度相互作用的细胞组成的。在细胞水平上,原肠运动涉及到上胚层细胞
(epiblast)
向多种细胞类型的快速分化以及不同细胞类型下细胞数目的扩增。这一过程是由细胞内基因的转录水平和表观修饰水平调控的
(细胞自主性;cell autonomous/cell intrinsic)
。在整个胚胎发育水平上,细胞分化又是不同细胞不断地对细胞间信号做出反应形成的,并且这些信号反过来又会诱导新的分化过程并以动态方式触发其他信号的分泌
(非细胞自主性;non-cell autonomous/ cell extrinsic)
。这使得研究细胞分化的调控机制变得极具挑战性。因为基因的细胞自主性功能可以发生在多个细胞类型中,并且随者发育时间的变化而变化;也可以通过各种信号通路对其他细胞类型产生影响。因此,当我们向正常的原肠胚发育过程引入突变等干扰因素,然后观测其对细胞分化的影响时,必须要在不同的发育时间内,将这种干扰因素所带来的细胞自主性效应与由于其他细胞类型中信号通路的扰动带来非细胞自主性效应作出区分。对于影响比较广泛和多效的基因调控机制来说,有效地区分直接和间接的基因功能尤为困难,一个较为突出的例子就是早期胚胎发育中细胞特异性DNA 甲基化的建立和维持。
2022年7月30日,来自以色列魏茨曼科学研究院的Yonatan Stelzer和 Amos Tanay 课题组在Cell上合作发表了题为
The instinct and extrinsic effect of TET protein during gastrulation
的研究论文。该研究
解析了DNA 去甲基化酶TET
(Ten-eleven translocation)
在小鼠原肠胚发育过程中调控细胞命运的功能和过程。
运用基于时间的细胞分化图谱,该研究详细阐述了TET在原肠胚形成过程中的细胞自主性效应与其产生的更为广泛的次级效应。
早期关于Tet基因功能的研究揭示了Tet在原肠胚发育中的重要作用, 并提出由TET介导的DNA去甲基化通过调控Lefty-Nodal信号通路,以及特异性地去除中胚层
(mesoderm)
增强子的甲基化来指导细胞分化
【1,5,6】
。但是,Tet纯合敲除小鼠
(Tet-TKO, Tet 1/2/3基因的三突变)
严重的胚胎缺陷使得人们无法区分哪些缺陷表型是由于Tet基因突变直接引起的,哪些是间接导致的。仅比较野生型和突变体之间的差异极大地限制了分析Tet基因细胞自主性功能的可能性。
为了研究Tet在原肠胚形成过程中的细胞自主性功能,课题组利用囊胚注射技术
(blastocysts injection)
得到了胚体全部由Tet-TKO 分化而来的突变体
(whole-embryo chimera/4N chimera)
和由Tet-TKO与野生型细胞共同发育而来的嵌合体
(mixed Chimera/2N chimera)
,并对这些胚胎进行了单胚胎水平的单细胞转录组测序。具体分析了在两种发育环境下,Tet-TKO细胞的引入(i)是否能改变胚胎内的细胞类型
(state perturbation)
, (ii) 是否影响胚胎内细胞类型的组成
(compositional perturbation)
,以及(iii)否影响胚胎内不同细胞之间的协同分化速率
(temporal perturbation)
。
运用囊胚注射技术研究原肠胚发育过程中基因的细胞自主性和非细胞自主性功能
通过与该课题组早前建立的单胚胎、单细胞小鼠原肠胚高时空分辨率模型进行系统性的比较
【7】
, 研究人员发现当胚胎全部由 Tet-TKO细胞分化而来时, 4N胚胎呈现出与Tet纯合敲除小鼠高度一致的发育缺陷; 而在嵌合体胚胎中,Tet-TKO细胞依然可以分化出几乎所有的细胞谱系。这一现象表明在嵌合体发育过程中野生型细胞为Tet-TKO细胞提供了正常的信号环境,并在很大程度上挽救了突变体中观察到的缺陷。由此表明,要正确阐述Tet基因的功能,需要充分考虑发育时间、细胞谱系以及细胞自主效应和细胞间 (非自主) 效应之间的相互作用。
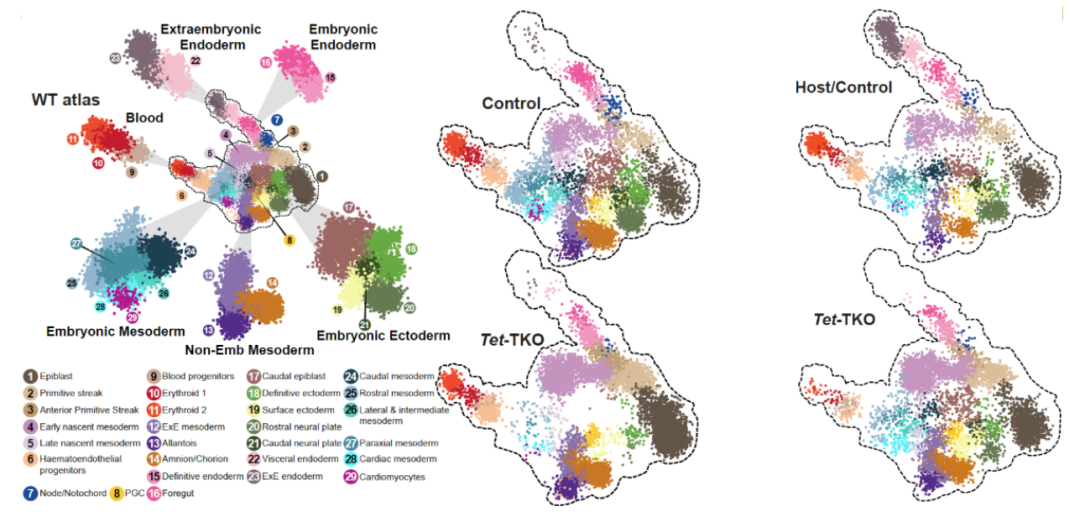
Tet-TKO及对照在四倍体互补胚胎 (左) 和嵌合体胚胎 (右) 中的分化
随后课题组发现4N胚胎之所以呈现出严重的发育缺陷,直接原因是上胚层细胞未能有效地抑制Dppa4, Gdf3等基因的表达,并且早期中胚层细胞
(early nascent mesoderm)
中多种信号通路也发生异常
(Lefty, FGF, Notch signaling pathway)
。具体来说,Tet基因的突变直接影响了早期上胚层细胞基因的表达,且导致早期中胚层细胞中Lefty2基因的表达显著降低。这使得上胚层中Nodal基因的表达未能得到有效抑制,从而上胚层不能正常分化为外胚层
(definitive ectoderm)
,转而更多地分化出中胚层谱系。而早期中胚层细胞中多种信号通路的异常进一步抑制了其分化成其他的成熟中胚层细胞谱系的能力。
全基因组DNA甲基化分析表明,虽然Tet基因的突变导致全基因组范围内增强子的高度甲基化,但是一些与发育相关基因的启动子并未完全甲基化,这很可能是突变体细胞在失去了去除DNA甲基化的能力的情况下,仍然能够在嵌合体环境中分化成几乎所有细胞谱系的原因。这一结果表明TET 介导的DNA去甲基化对原肠胚时期的大多数细胞分化程序来说是非必需条件,且并不具有传统观点认为的指导性作用。结合对嵌合体中转录组的分析,该研究认为TET 介导的DNA去甲基化更倾向于在全基因组范围内微调基因的表达。
这一研究发现,为理解表观遗传调控 (尤其是DNA去甲基化) 在细胞分化中的作用提供的新的观点,同时该研究也提供了一套研究胚胎发育时期基因功能的方法,使得我们能够有效地探究并区分基因的自主效应和与非自主效应。对于不同的研究对象和系统,开发新的研究方法来区分基因的直接与间接效应将有助于我们理解复杂的调控机制,进而更加正确地认识生物学过程。
魏茨曼科学研究院的博士后程赛凤和Markus Mittnenzweig为本文的共同第一作者。Yonatan Stelzer和Amos Tanay为本文的共同通讯作者。该工作也得到了Yonatan Stelzer和 Amos Tanay课题组成员的支持与帮助。
https://doi.org/10.1016/j.cell.2022.06.049
制版人:十一
1. R. Argelaguet et al., Nature. 576, 487–491 (2019).
2. G. Peng et al., Nature. 572, 528–532 (2019).
3. B. Pijuan-Sala et al., Nature. 566, 490–495 (2019).
4. S. R. Srivatsan et al., Science. 373, 111–117 (2021).
5. H.-Q. Dai et al., Nature. 538, 528–532 (2016).
6. J. Kang et al., Proc. Natl Acad. Sci. USA. 112, E4236–E4245 (2015).
7. M. Mittnenzweig et al., Cell. 184, 2825-2842.e22 (2021).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。






 药选址
药选址




