
2015年,Richard Flavell和Erol Fikrig实验室报道肠道特有的Nod样受体NLRP6在空肠(jejunum)介导识别脑心肌炎病毒和诺如病毒(EMCV and MNV,ssRNA(+))中的重要作用【5】,朱书(现就职于中科大)和王鹏华(现就职于康州大学)是该文的并列第一作者。2017年,Richard Flavell和Harry Greenberg实验室再次报道另外一个肠道特异表达Nod样受体NLRP9b在回肠(ileum)识别双链RNA病毒——轮状病毒(rotavirus)的重要作用,并发现NLRP6有一定直接结合双链RNA(dsRNA)的能力但是NLRP9b是间接结合dsRNA 【6】。朱书和丁思远(现就职于华盛顿大学圣路易斯分校)是该文的并列第一作者。Nod样受体在十多年前就被发现可以在配体激活的情况下形成炎症小体(inflammasome)聚集,但是一直未有确切的证据证明此过程中有相分离的发生。而有趣的是,大部分液相分离是由核酸及其结合蛋白形成的【1,7】,因此潜在的RNA识别受体NLRP6成为了研究炎症小体和LLPS关联的突破口。
2021年10月21日,哈佛大学医学院吴皓课题组联合中国科学技术大学朱书课题组在Cell发表题为Phase Separation Drives RNA Virus-Induced Activation of the NLRP6 Inflammasome 的研究论文,发现了dsRNA可以诱导NLRP6发生相分离进而激活炎症小体抗病毒免疫反应。

研究人员首先纯化了NLRP6蛋白,针对目前报道的一系列NLRP6的潜在配体dsRNA,LTA,metabolites,LPS【5,8-10】等通过一系列体外实验(EMSA、MST)确定dsRNA和NLRP6的结合最强(Kd=1.2±0.2μM)且随着RNA的长度增加亲和力也随之增加,此外LTA也可以和NLRP6结合,但亲和力稍弱(Kd=6.5±0.8μM)。
随后研究人员发现dsRNA与NLRP6在体外以及细胞中都可以形成液滴聚集体,研究人员通过荧光漂白恢复实验以及凝聚体融合等实验证明了dsRNA与NLRP6的确通过液液相分离形成凝聚体(图一)。
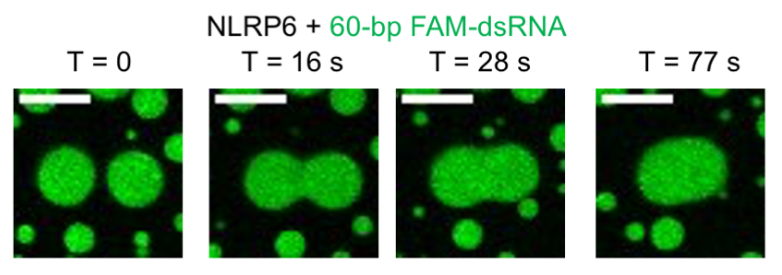
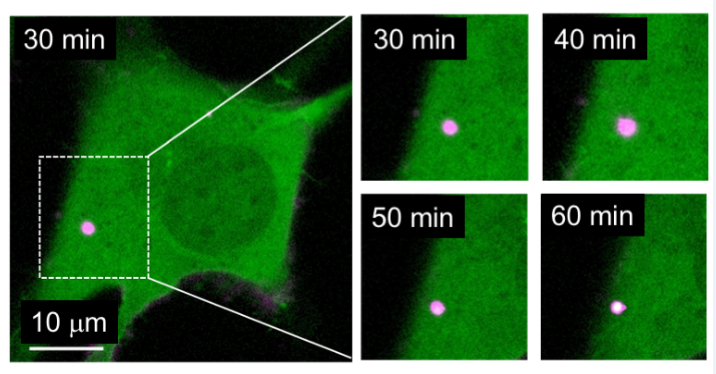
图一 dsRNA在体外和细胞内诱导NLRP6液液相分离
那么dsRNA与NLRP6是如何形成液液相分离的呢?研究人员通过光控(Opto-genetics)等实验发现NLRP6蛋白序列中含有内在无序区(IDR),在对IDR序列进行比对的过程中发现高频的带正电荷氨基酸——赖氨酸在不同物种中具有高度保守性,这提示着该区域对于液液相分离的形成具有特殊的意义。多价相互作用已经被证明在液液相分离中起到关键作用,核酸与蛋白质形成的静电相互作用导致多价相互作用的形成也有许多研究报道【1,2】。因此研究人员猜测NLRP6 IDR区域的多个赖氨酸重复介导的多价相互作用介导了LLPS的形成。的确,体外表达纯化突变体以及细胞内外源表达突变体等实验表明多个赖氨酸是dsRNA与NLRP6液液相分离的重要结构(图二)。
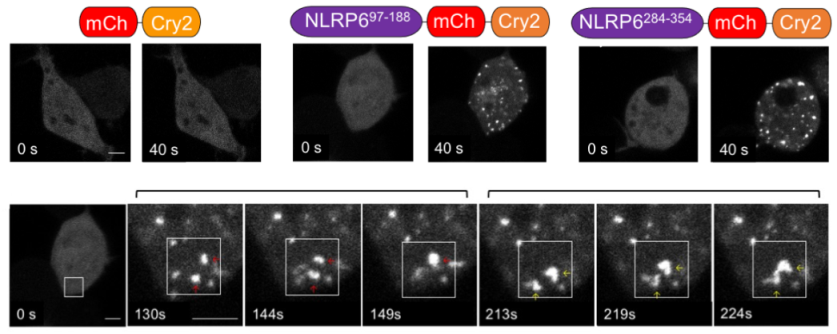
图二 NLRP6 IDR介导的液液相分离
为了探究赖氨酸对液液相分离的影响,研究人员构建了赖氨酸突变体,通过体外表达纯化蛋白及一系列的细胞实验发现,突变体的确抑制了NLRP6的液液相分离,通过光控实验发现其多价相互作用较野生型小,且会影响NLRP6的自我聚集。同时功能试验表明,细胞外源表达突变体较野生型而言明显抑制NLRP6炎症小体的激活——细胞焦亡的产生,以上证据表明,多个赖氨酸区域是启动NLRP6液液相分离以及后续炎症小体激活的关键,多价相互作用是NLRP6液液相分离的关键作用力(图三)。
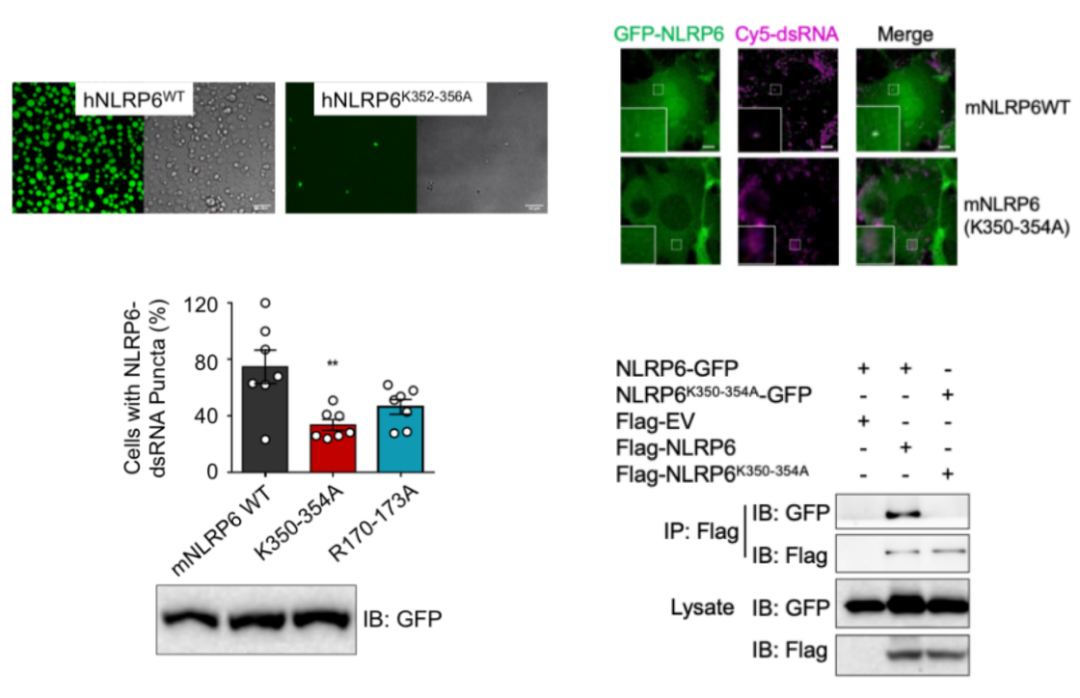
图三 赖氨酸突变体抑制NLRP6液液相分离
进一步地,研究人员想在小鼠体内探究液液相分离的作用。NLRP6之前被报道在肠道上皮细胞高表达【5】,研究人员也发现NLRP6也可以特异表达在肝实质细胞(NLRP3和NLRP9b均不表达)。鉴于NLRP6在肠道和肝脏的高表达,研究人员构建了轮状病毒(Rotavirus, RV)感染肠道和小鼠肝炎病毒(Mouse hepatitis virus,MHV)感染肝脏的病毒感染模型。在轮状病毒感染实验中,研究人员发现NLRP6敲除小鼠的肠道的GSDMD剪切减弱以及IL-18分泌明显下降,说明NLRP6在肠道缺失会显著抑制轮状病毒感染激活的炎症小体。同时,研究人员也对野生型以及NLRP6敲除小鼠进行了MHV感染,同样发现病毒感染后NLRP6敲除小鼠的GSDMD剪切以及IL-18分泌明显较野生型小鼠减少,并且当敲除NLRP6或其它炎症小体组分时,病毒载量均较野生型升高,以上证据充分说明MHV感染小鼠导致NLRP6炎症小体的激活,NLRP6敲除会抑制炎症小体激活,导致病毒感染增多。为了进一步检测小鼠体内凝聚体的形成,通过免疫荧光实验发现在野生型小鼠的肝脏切片中出现了dsRNA与NLRP6以及ASC与NLRP6形成的凝聚体,而该凝聚体在NLRP6敲除小鼠无法形成,说明MHV感染的确可以诱导NLRP6凝聚体的形成。
那么如果阻断液液相分离,是否对体内的病毒感染有影响呢?研究人员通过CRISPR Cas9技术构建了赖氨酸突变鼠,对其分别进行了RV和MHV感染,检测突变小鼠的肠道炎症小体,发现与NLRP6敲除相似的现象—GSDMD剪切明显减少以及IL-18分泌减少,在MHV模型中检测肝脏切片发现突变鼠的凝聚体明显减少,且炎症小体的激活明显受到抑制,以上证据说明赖氨酸的突变(抑制液液相分离)抑制了NLRP6炎症小体的激活。
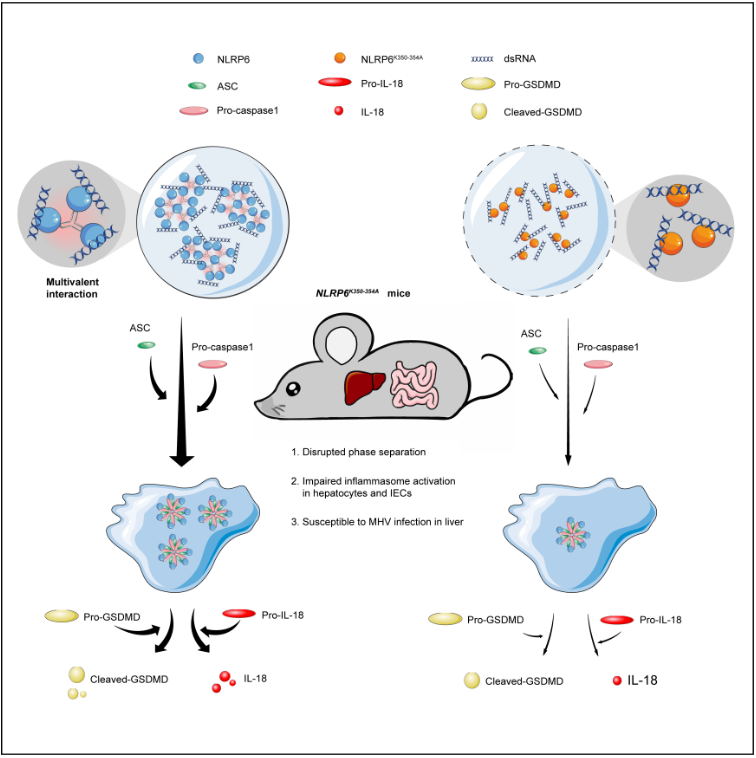
该论文的创新之处在于:1.首次提供明确的证据炎症小体形成过程中发生了LLPS;2. NLRP6识别RNA形成LLPS作为一个介导信号通路的平台,解释了NLRP6介导和整合多种信号(RNA,LTA,inflammasome, interferon)的能力;3. 首次通过构建Ploy K突变小鼠影响NLRP6多价相互作用的方式证明LLPS在生理条件下的功能。
哈佛大学医学院吴皓教授和中国科学技术大学免疫学研究所朱书教授为论文共同通讯作者,吴皓教授课题组负责了本文体外现象和机制的研究,朱书教授课题组负责本文中细胞现象和机制,以及小鼠模型的研究。哈佛大学医学院吴皓课题组的Chen Shen (沈辰) 和中国科学技术大学朱书课题组的博士研究生Runzhi Li (李润智) 为共同第一作者。本工作得到了中国科大田志刚教授,耶鲁大学Richard Flavell教授,生物物理所高璞研究员,中国科大周荣斌教授、金腾川教授,北京大学胡家志教授、季雄教授,中山大学郭德银教授的帮助。
原文链接:
https://doi.org/10.1016/j.cell.2021.09.032
参考文献
[1]Alberti S, Gladfelter A, Mittag T. Considerations and Challenges in Studying Liquid-Liquid Phase Separation and Biomolecular Condensates. Cell. 2019 Jan 24;176(3):419-434. doi: 10.1016/j.cell.2018.12.035.
[2]Boeynaems S, Alberti S, Fawzi NL, Mittag T, Polymenidou M, Rousseau F, Schymkowitz J, Shorter J, Wolozin B, Van Den Bosch L, Tompa P, Fuxreiter M. Protein Phase Separation: A New Phase in Cell Biology. Trends Cell Biol. 2018 Jun;28(6):420-435. doi: 10.1016/j.tcb.2018.02.004.
[3]Du M, Chen ZJ. DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science. 2018 Aug 17;361(6403):704-709. doi: 10.1126/science.aat1022.
[4]Su X, Ditlev JA, Hui E, Xing W, Banjade S, Okrut J, King DS, Taunton J, Rosen MK, Vale RD. Phase separation of signaling molecules promotes T cell receptor signal transduction. Science. 2016 Apr 29;352(6285):595-9. doi: 10.1126/science.aad9964.
[5]Wang, P., et al., Nlrp6 regulates intestinal antiviral innate immunity. Science, 2015. 350(6262): p. 826-830.
[6]Zhu S, Ding S, Wang P, Wei Z, Pan W, Palm NW, Yang Y, Yu H, Li HB, Wang G, Lei X, de Zoete MR, Zhao J, Zheng Y, Chen H, Zhao Y, Jurado KA, Feng N, Shan L, Kluger Y, Lu J, Abraham C, Fikrig E, Greenberg HB, Flavell RA. Nlrp9b inflammasome restricts rotavirus infection in intestinal epithelial cells. Nature. 2017 Jun 29;546(7660):667-670. doi: 10.1038/nature22967.
[7]Murray DT, Kato M, Lin Y, Thurber KR, Hung I, McKnight SL, Tycko R. Structure of FUS Protein Fibrils and Its Relevance to Self-Assembly and Phase Separation of Low-Complexity Domains. Cell. 2017 Oct 19;171(3):615-627.e16. doi: 10.1016/j.cell.2017.08.048.
[8]Hara H, Seregin SS, Yang D, Fukase K, Chamaillard M, Alnemri ES, Inohara N, Chen GY, Núñez G. The NLRP6 Inflammasome Recognizes Lipoteichoic Acid and Regulates Gram-Positive Pathogen Infection. Cell. 2018 Nov 29;175(6):1651-1664.e14. doi: 10.1016/j.cell.2018.09.047.
[9]Levy M, Thaiss CA, Zeevi D, Dohnalová L, Zilberman-Schapira G, Mahdi JA, David E, Savidor A, Korem T, Herzig Y, Pevsner-Fischer M, Shapiro H, Christ A, Harmelin A, Halpern Z, Latz E, Flavell RA, Amit I, Segal E, Elinav E. Microbiota-Modulated Metabolites Shape the Intestinal Microenvironment by Regulating NLRP6 Inflammasome Signaling. Cell. 2015 Dec 3;163(6):1428-43. doi: 10.1016/j.cell.2015.10.048.
[10]Leng F, Yin H, Qin S, Zhang K, Guan Y, Fang R, Wang H, Li G, Jiang Z, Sun F, Wang DC, Xie C. NLRP6 self-assembles into a linear molecular platform following LPS binding and ATP stimulation. Sci Rep. 2020 Jan 13;10(1):198. doi: 10.1038/s41598-019-57043-0.
(可上下滑动阅览)
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




