引 言
相信很多同行都知道开题报告的重要性,它是立项阶段到研究阶段的桥梁,具有承上启下的作用。开题报告是项目立项后的一个具体实施计划,也是项目工作开展的主要依据。
开题报告主要包括:项目概况,项目难点分析,风险评估,项目实施计划等。下面以某制剂品种为例,简单介绍一下如何写开题报告。
项目概况主要是项目来源、境内外上市情况、原研产品情况、国内申报现状、知识产权分析、拟开发产品情况等。
1.1项目来源
根据立项阶段调研的该品种的临床价值和市场需求,并对该项目的技术、注册、专利情况等进行综合评估,确定开展此项目。一般CRO项目来源只要分为两种,一种是承接项目,即药厂委托研究的项目;一种是自研项目,即公司自主研发的项目。
1.2境内外上市情况
在CFDA、FDA、EMA、PMDA及各国药监局官网可以查询该品种的上市情况,确定原研(或参比)产品及产地。
1.3原研产品情况
确定了原研产品,将确定的原研产品信息详细描述(如通用名、剂型、规格、适应症、给药途径、处方信息、上市信息、业务交易等)。
1.4国内申报与审评现状
通过CFDA、CDE、药智网等查询该品种目前的申报现状、审评审批情况、获得批准文号情况等,并进行归纳总结,暂定申报类型,申报类型参考下表:
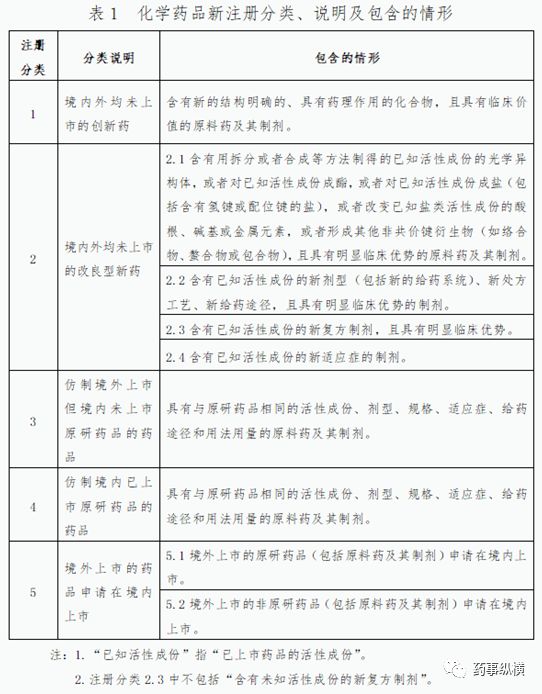
申报类型需随时关注国内市场变化情况及时调整。
1.5知识产权分析
经对世界知识产权组织、中国专利库、美国专利库、欧洲专利库、日本专利库的检索,结果如下:

经检索,一般分为两大情况:
①该品种在中国无专利,所以在中国开发该品种不存在侵权风险。
②该品种在中国有专利但专利已失效或可以合理规避,所以在中国开发该品种不存在侵权风险。
专利的保护范围应以授权的专利文本的权利要求书为准,但凡「发明专利申请公布后的视为撤回」,「发明专利申请公布后的驳回」,「专利权终止」等申请或专利均处于无效状态,这些申请或专利对仿制药的开发不会造成实质性影响。
专利的法律状态是一个动态过程,需随时对与被仿制药相关的专利在中国的法律状态进行升级更新。例如,一项处于「实质审查的生效」的专利申请经一段时间后,其法律状态有可能会变为「发明专利申请公布后的视为撤回」,「发明专利申请公布后的驳回」,甚至「授权」。此外,还应随时跟进原研公司或仿制药公司后续申请的 PCT 专利在中国的情况。
更多专利知识详见“防侵权 | 仿制药立项中有关专利的几大思考,并教你合理规避专利”。
1.6拟开发产品
根据前期调研资料和原研产品确定拟开发产品的通用名、剂型、规格、适应症、给药途径、预期的临床用途、处方信息、包材等,初步确定拟开发产品的处方和工艺参数。
根据原研剂型规格,原研说明书、原料药的理化性质、标准及文献等确定该项目的难点。
关于工艺研究,如:主成分对温度非常敏感,工艺参数中温度就要严格控制;小剂量品种就要特别关注中间体/混合粉的混合均匀度,成品的含量均匀度;主成分对湿度敏感,制剂工艺中就要根据敏感程度确定环境湿度和制粒方法等等。
关于质量研究,如:有遗传毒性杂质,那么在起源就要严格控制该杂质;测得未知杂质较大超过鉴定限,要对该杂质进行结构确认;进行本品对光不稳定,那么难点就是各操作避光来提高本品的稳定性,等等。
风险评估是质量风险管理(见ICH Q9)中一个重要的、以科学为依据的过程。
3.1知识产权风险评估
根据前期专利调研,本项目在研发过程中不会存在侵犯专利行为,知识产权风险较低。
3.2技术风险评估
根据项目难点分析,提出相应的解决方案,证明本项目在研发过程中能顺利进行,技术风险较低。
如主成分对光敏感,制剂工艺中就要根据主成分对光敏感程度,确定制备现场的光线强弱,包衣层、包材、内包装、外包装等进行调整,确定合适的工艺;对于无菌制剂,需选择适合灭菌的方法和内包装材料等。
3.3注册风险评估
根据前期对本品上市情况和国内申报审批情况调研,随时关注国内市场变化情况及时调整申报类型,按注册分类要求申报,注册风险较低。
通常风险评估在药品研发的早期进行,而随着所获得的信息和知识的增加,该评估还需反复进行。
根据前期文献调研和标准查询收集的有关项目信息制定本项目实施计划。项目实施计划主要包括项目预算、仪器设备采购、物料采购、人员配备、工作计划表等。
4.1项目预算
基于项目的采购需求、人员配备、研究周期制定本项目的预算。
4.2仪器设备采购
一般来说常见通用的仪器不需采购,用到特殊仪器或者检测器的需要进行采购,这就需要根据本前期调研文献收集所需要的仪器设备,尤其是公司未配备的设备,分部门逐一列出。如:

4.3物料采购
物料包含起始物料、原辅料、包材、对照品、参比制剂、试剂、色谱柱等,分部门逐一列出。如对照品采购信息:

4.4人员配备
确定项目管理人员、项目经理、合成负责人及实验员、制剂负责人及实验员、分析负责人及实验员,并明确各岗位职责。
4.5工作计划表
根据人员安排及实际工作量确定时间段,由此为依据来把控项目进度,中间出现问题及时申请调整。
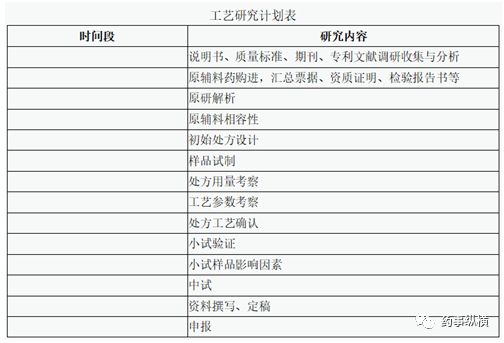
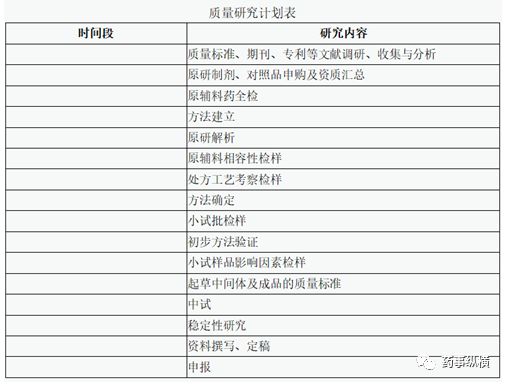
注:上表仅作为参考,根据品种实际情况制定详细计划。
另,制剂和分析可以制定各自的详细计划表及初步实验方案,以附件形式附在开题报告之后。
以上仅根据个人经验总结,如有不同意见,欢迎交流。
参考文献:
1.“防侵权| 仿制药立项中有关专利的几大思考,并教你合理规避专利”,雷诺岛
2.化学药品注册分类改革工作方案,CFDA

↓↓点击海报了解药融圈2022年度会议计划↓↓
各位朋友好,觉得本文对您有帮助,请随手点一下下方的在看,以便让你的朋友也能看到哦。



 个人中心
个人中心
 我是园区
我是园区





