精彩内容
根据美国食品和药物管理局(FDA)的数据统计,8月FDA共批准4款创新药物,分别为治疗晚发性庞贝病的Nexviazyme(avalglucosidase alfa-ngpt);治疗希佩尔·林道综合征相关癌症的Welireg(belzutifan);治疗血液透析患者瘙痒症的Korsuva(difelikefalin);以及治疗生长激素缺乏症的Skytrofa(lonapegsomatropin-tcgd)。2021年至今,美国FDA已陆续批准了36款创新药物,其中27款为新分子实体,9款为新生物制品。
近十年FDA批准的新药数量

来源:FDA网站、公开资料
2021年8月,美国FDA批准的4款创新药物分布在不同的治疗领域:消化系统及代谢药物Nexviazyme、抗肿瘤和免疫调节剂Welireg、皮肤病用药Korsuva,全身用激素类制剂(不含性激素)Skytrofa。同时,Welireg的活性成分belzutifan是FDA批准的首个HIF-2α抑制剂;Korsuva的活性成分difelikefalin是首个靶向KOR的激动剂。
值得一提的是,4款创新药物均已在中国申报临床,其中长效生长激素lonapegsomatropin由维昇药业引入国内,目前3期临床试验正在进行中。
FDA批准新药的详细信息

来源:FDA网站、米内网全球药物研发库
Nexviazyme(avalglucosidase alfa-ngpt)
2021年8月6日,美国FDA批准赛诺菲旗下的Nexviazyme(avalglucosidase alfa-ngpt)上市,用于治疗1岁及以上的晚发性庞贝病。Nexviazyme是继Lumizyme/Myozyme(alglucosidase alfa,重组阿葡糖苷酶α)的第二代治疗庞贝病的酶替代疗法,这两款均由赛诺菲研发的新药也是迄今为止仅有的FDA批准的庞贝病特异性疗法。此前,Nexviazyme曾获得美国FDA授予的突破性药物、快速通道、优先审查和孤儿药等资格认定。目前,Nexviazyme在欧盟已获得人用药品委员会(CHMP)的积极推荐,预计在9月得到最终审查结果。
avalglucosidase alfa具体信息
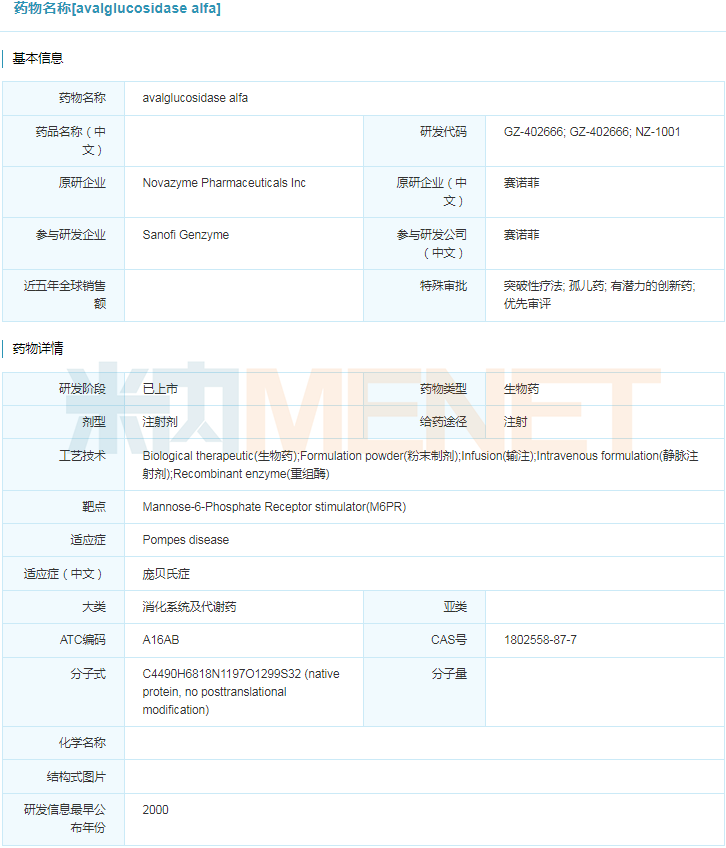
来源:米内网全球药物研发库
庞贝病,又叫做II型糖原贮积症,是运动障碍疾病中一种罕见遗传病。该病是由于身体缺乏分解糖原为葡萄糖的酸性α-葡萄糖苷酶,导致肌肉、心肌、骨骼肌和呼吸肌受到严重且不可逆的损伤,出现肌肉无力、呼吸衰竭或心力衰竭导致的过早死亡。据统计,每40000/50000名新生儿中就有1人会发病。
一项名为COMET的关键3期临床试验为此次批准奠定基础。COMET研究结果显示,使用Nexviazyme治疗第49周时,Nexviazyme组的用力肺活量预测值百分比与基线相比改善2.9分,与对照组相比改善2.4分。总的来说,试验达到改善呼吸功能的主要终点。在另一6分钟步行测试中,使用Nexviazyme治疗第49周时,与基线相比,Nexviazyme组步行距离为32.2米,比活性对照组远30米,达到试验能耐力与活动能力的关键次要终点。
Welireg(belzutifan)
2021年8月13日,美国FDA批准默沙东开发的Welireg(belzutifan)上市,用于治疗不需要立即手术的希佩尔·林道综合征(VHL)疾病相关癌症患者,包括肾细胞癌(RCC)、中枢神经系统血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)的患者。Welireg是全球首款也是唯一一款被批准用于希佩尔·林道综合征疾病患者全身治疗的药物,也是FDA批准的首个HIF-2α抑制剂疗法。此前,美国FDA已授予Welireg突破性药物、优先审查和孤儿药等资格认定。
belzutifan具体信息

来源:米内网全球药物研发库
希佩尔·林道综合征是一种罕见的影响多器官的遗传性疾病,据统计,希佩尔·林道综合征的患病率为36000分之一,现全球约有20万例患者,在美国患者人数达1万人。VHL基因是一种重要的肿瘤抑制基因,其突变导致VHL患者有患良性血管肿瘤以及包括肾细胞癌在内的多种癌症的风险。高达70%的希佩尔·林道综合征患者发生肾细胞癌,这是希佩尔·林道综合征患者死亡的主要原因。
此次批准是基于2期Study 004临床研究数据。结果显示,在61例希佩尔·林道综合征相关肾细胞癌患者中,客观缓解率(ORR)为49%,均为部分缓解(PR);在24例希佩尔·林道综合征相关中枢神经系统血管母细胞瘤患者中,客观缓解率(ORR)为63% ,完全缓解率(CR)为4%,部分缓解率(PR)为58%;而在12例希佩尔·林道综合征相关胰腺神经内分泌肿瘤患者中,客观缓解率(ORR)为83%,完全缓解率(CR)为17% ,部分缓解率(PR)为67% 。
Korsuva(difelikefalin)
2021年8月23日,Cara Therapeutics公司宣布,美国FDA已批准Korsuva(difelikefalin)上市,用于治疗接受血液透析的成人慢性肾病(CKD)相关的中度至重度瘙痒症。Korsuva是FDA批准的首款也是目前唯一一款用于治疗这类患者瘙痒症的创新疗法。而且,Korsuva活性药物成分difelikefalin是一种首创(first-in-class)KOR激动剂,作用于人体外周神经系统和某些免疫细胞。此前,该药曾获得美国FDA授予的突破性疗法和优先审评资格认定。
difelikefalin具体信息

来源:米内网全球药物研发库
慢性肾脏疾病相关的瘙痒症是肾脏疾病患者进展期或晚期常见的疾病,在接受透析的慢性肾脏疾病患者中,其发生频率高、强度大,主要累及面部、胸部和四肢。据统计,接受透析患者出现瘙痒的概率约在60%~70%,其中出现中重度瘙痒症状的患者约占30~40%。在慢性肾脏疾病相关瘙痒症患者中,约59%的患者几乎每天都会出现瘙痒症状,且持续一年以上。中重度慢性瘙痒被证明会直接影响患者生活质量,如导致睡眠质量差,甚至产生抑郁症等。
此次批准主要基于两项关键的3期关键试验的积极结果,以及其他32个临床研究的支持性数据。在两项关键性3期临床试验中,接受Korsuva治疗的患者在评估瘙痒的WI-NRS评分上改善3分及以上的为54%,而安慰剂组中达到这一水平的患者比例为42%,达到该试验的主要终点。此外,接受Korsuva治疗的患者中有41%患者的WI-NRS评分较基线时改善4分或以上,而安慰剂组仅为28%,达到该试验的关键性次要终点。
Skytrofa(lonapegsomatropin-tcgd)
2021年8月25日,Ascendis Pharma公司研发的Skytrofa(lonapegsomatropin-tcgd)获得美国FDA批准上市,用于治疗体重至少11.5公斤,因内源性生长激素(GH)分泌不足而导致生长障碍的一岁及以上儿童患者。Skytrofa是一周使用一次的长效生长激素制剂,也是首款获得FDA批准的在一周时间里持续释放生长激素的药物。此前,该药曾获得美国FDA授予的孤儿药资格认定。
lonapegsomatropin具体信息

来源:米内网全球药物研发库
生长激素缺乏症是一种因脑下垂体不能产生足够的生长激素而导致身材矮小和产生代谢并发症的疾病。据统计,在美国,身材矮小症的患病率约为2%,我国报道的数据为3%。生长激素除了对儿童身高发育影响很大之外,还对患儿的物质代谢产生重要影响。缺乏生长激素可能会导致肌肉体积减小、肥胖、黄疸消退延迟、小阴茎、骨龄落后等。
Skytrofa的安全性和有效性在3期heiGHt临床试验中得到支持。161名无治疗史生长激素缺乏症患儿参与此次研究,比较每周一次的Skytrofa与每日生长激素Genotropin(Somatropin)。研究结果显示,在第52周时,两者生长速度的治疗差异为0.9cm/year ,其中Skytrofa组为11.2cm/year,Genotropin组为10.3cm/year。在该试验中,Skytrofa达到了生长速度主要终点,并且与每日生长激素Genotropin相比,Skytrofa在治疗患有GHD的生长激素缺乏症患儿时有更高52周的生长速度,且安全性相似。
资料来源:FDA官网、企业公告、米内网数据库,如有错漏,敬请指正。
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092



 个人中心
个人中心
 我是园区
我是园区




