融合CAR-T和TCR-T优点的新型细胞疗法,显著提升实体瘤疗效|Science子刊
收藏
关键词:
CAR瘤Science细胞疗法
资讯来源:创鉴汇 + 订阅账号
发布时间:
2021-03-30
表达嵌合抗原受体(CAR)的T细胞(CAR-T疗法)是近年来癌症治疗领域的重大突破之一,在治疗血液癌症方面取得了卓越疗效。迄今为止,全球范围内已有多款靶向CD19的CAR-T疗法成功上市,用于治疗B细胞恶性肿瘤。但是CAR-T疗法在治疗实体瘤方面仍然存在许多障碍,究其原因,主要在于实体瘤的细胞疗法存在不少难点,如不同类型实体瘤的异质性大、缺乏独特的肿瘤相关抗原作为CAR-T靶点、T细胞无法有效归巢到肿瘤部位、CAR-T细胞持续性不够以及肿瘤内复杂的微环境对免疫有抑制作用等原因。

CAR主要由三个功能域构成,分别是胞外结构域、跨膜结构域和胞内结构域。胞外结构域由负责识别并结合抗原的单克隆抗体的单链可变片段(single-chain variable fragment,scFv)及一段起连接作用的铰链区(Hinge)构成。胞内结构域由共刺激结构域(Costimulatory Domain)和信号转导结构域(Signaling Domain)构成。
TCR免疫疗法通过对T细胞表面表达的T细胞受体进行改造,让它们更有效地识别肿瘤抗原,提高对肿瘤细胞的杀伤能力。TCR免疫疗法的优势在于它可以识别肿瘤细胞内部表达的抗原,因此扩展了TCR免疫疗法靶向的靶标范围。近日,Science子刊Science Translational Medicine发表了最新研究Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors ,研究人员通过结合CAR-T与TCR-T技术的优势,设计了新型STAR-T细胞疗法,并在多种实体瘤模型中展示出优于CAR-T疗法的疗效。

研究团队首先设计并构建了一种新型嵌合受体,将其命名为合成T细胞受体抗原受体(Synthetic T cell receptor and Antigen Receptor,STAR)。STAR使用了CAR胞外结构域中的抗体scFv负责识别并结合抗原,恒定区则为TCR恒定区,保留的TCR的天然活化信号,STAR-T疗法融合了CAR-T与TCR-T技术的优势。
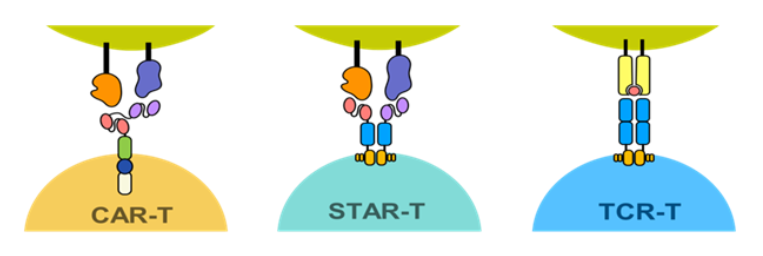
▲CAR-T, TCR-T, STAR-T 结构示意图(图片来源:China Immunotech官网)
研究人员首先测试了STAR-T细胞对于抗原刺激的反应情况,结果显示在不受抗原刺激时,STAR-T细胞没有被激活,而当STAR-T细胞受到抗原刺激,则表现出较强的激活效应,表明STAR-T细胞对于特定抗原刺激敏感。当STAR-T细胞处于激活状态,与CAR-T细胞相比,展现出更优的抗原敏感性,并且具有更好的增殖能力。
紧接着,在靶向EGFR、GPC3等靶点的多种动物模型中,STAR-T细胞展现出优于传统CAR-T细胞的抗肿瘤效果,并且无明显的毒副作用。体内试验表明,STAR-T细胞疗法对于实体瘤的疗效显著,并且优于CAR-T疗法。
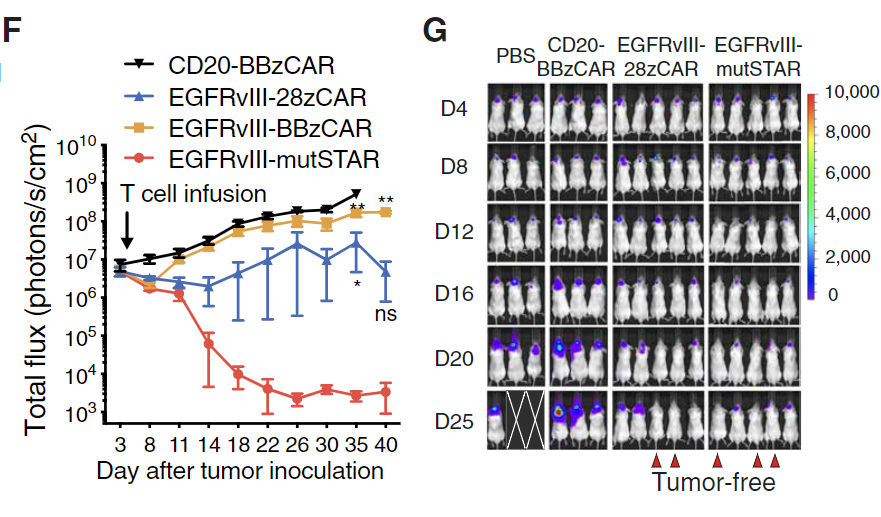
▲在靶向EGFR的动物模型中,STAR-T细胞展现出优于CAR-T细胞的抗肿瘤效果(图片来源:参考资料[1])
值得注意的是,华夏英泰(China Immunotech)公司正在开发STAR-T细胞疗法相关在研产品,其在研管线包括靶向CD19、BCMA、Claudin18.2等一系列癌症靶点的STAR-T疗法,用于治疗肝癌、胃癌等多种癌症。我们也期待,能有基于此基础的创新疗法尽早问世,造福广大患者。
[1] Yue Liu et al. Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors. Science translational medicine, Nat Med 13
, eabb5191 (2021). DOI: 10.1126/scitranslmed.abb5191
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「创鉴汇」微信公众号回复“转载”,获取转载须知。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。

点击“在
看
”,分享创鉴汇健康新动态






 药选址
药选址




