
责编 | Qi
哺乳动物身体计划的建立发生在胚胎植入母体子宫后不久,但对植入子宫后发育过程由于子宫的遮挡而很难被观察和监测,因此我们对于该过程中发生事件的了解仍然有限。
2021年3月17日,以色列魏茨曼科学研究学院Jacob H. Hanna研究组、Alejandro Aguilera-Castrejon(第一作者)以及以色列理工学院Itay Maza研究组在Nature杂志上合作发文题为 Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis 的文章,通过监测小鼠在子宫外的发育揭开了从前原肠形成到晚期器官形成过程的秘密。

为了进一步理解和控制从原肠形成前到器官发生的发育事件的顺序,作者们开始测试一些新建立的细胞培养补体系,希望帮助解决子宫外观测小鼠生长的遇到难题与挑战。为此,作者们建立了一个名为“滚筒培养系统”(Roller culture system)的体系(图1),可以高精准度地调控氧气和二氧化碳的含量,而且可以对压强进行控制。体系的压强或者说机械力对于胚胎的发育也是非常关键的因素【4, 5】。随后作者们对培养液的配方进行了进一步地确认,发现25%的DMEM、50%的大鼠血清以及25%的人脐带血血浆可以在此系统中高效地支持小鼠胚胎的生长。作者们还发现每24小时在培养基中加入额外的葡萄糖对于克服体外培养过程中会出现的畸形非常关键。除此之外,还需要逐渐提高培养过程中氧气含量的补给。但是在需要提出的一点是,在子宫外滚筒系统培养4天后,胚胎会开始出现畸形并且在第二天很快死掉,这是因为体外系统氧气不足以及营养不能匹配体外逐渐增加的胚胎体积有关,这与胎儿水肿(Hydrops fetalis)现象相一致。
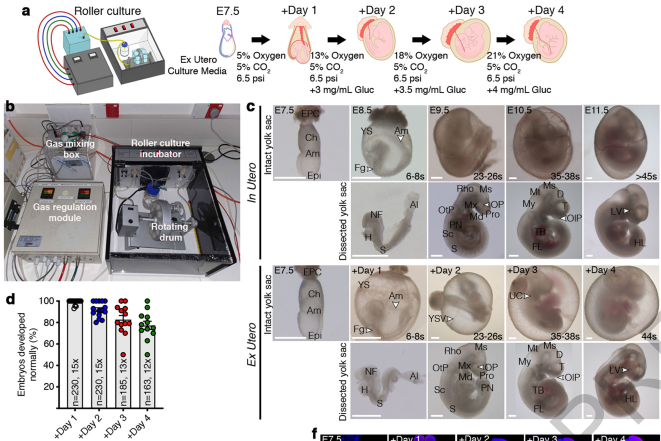
图1. “滚筒培养系统”以及小鼠胚胎子宫内/外的培养情况对比
在确定最佳的培养方案之后,作者们对该系统中进行子宫外小鼠胚胎中发育形态标记物【6】进行了检测,以确认子宫外培养的小鼠胚胎发育过程与正常子宫内培养的小鼠胚胎具有相一致。通过细胞标记物免疫染色的结果可以发现与子宫内发育的时期相一致,另外培滚筒系统培养的胚胎的尺寸也与子宫内发育的胚胎类似。该结果说明子宫外培养系统可以很好地概括小鼠胚胎发育到44体节阶段,也就是胚胎后11天左右的阶段。
进一步地,为了确认子宫外滚筒培养体系所培养的胚胎中谱系的特征以及与子宫内培养的胚胎的转录图谱,作者们进行了单细胞的RNA-seq,将子宫内胚胎与滚筒培养体系中得到的胚胎细胞进行比较。作者们发现该培养基条件忠实地再现了胚胎从胚原形成开始直到体细胞发生的发育过程。
该体外滚筒培养体系的一大优势就是可以将多种实验操作直接应用于移植后的小鼠胚胎之中,通过直接追踪观测这些操作带来的影响。举例来说,作者们对早胚胎后期8.5天的小鼠胚胎中进行了全胚胎电转实验,GFP质粒可以通过电转进入神经管标记一系列神经细胞。电转后的胚胎可以继续放入子宫外滚筒培养体系之中,其中68%的胚胎可以在电转后继续正常发育,而且可以在神经组织中表达GFP的信号(图2)。另外,与慢病毒转导技术联用也可以将目的标记加入到胚胎之中。除此之外,作者们还将一些人多能干细胞注射进入小鼠胚胎之中对形成的嵌合体在体外进行观测。因此,该体系可以用于阐明在跨物种胚胎嵌合体背景下人类细胞的发展。
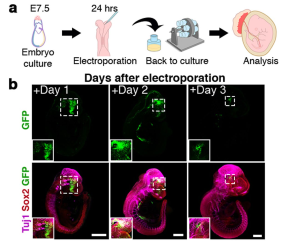
图2. 滚筒培养体系与全胚胎电转联用
总的来说,该工作建立了一个能够在体外模拟子宫内培养的“滚筒培养系统”,打破了一直以来被子宫遮住的胚胎发育过程研究的瓶颈。该体系构建了一个能够用来研究不同扰动对于胚胎发育过程的影响,同时也证实了哺乳动物中原肠形成以及器官发生过程可以在培养皿中被完整而充分地重现。
参考文献
1. Bedzhov, I. & Zernicka-Goetz, M. Self-organizing properties of mouse pluripotent cells initiate morphogenesis upon implantation. Cell 156, 1032-1044, doi:10.1016/j.cell.2014.01.023 (2014).
2. White, M. D. et al. Long-Lived Binding of Sox2 to DNA Predicts Cell Fate in the Four-Cell Mouse Embryo. Cell 165, 75-87, doi:10.1016/j.cell.2016.02.032 (2016).
3. Huang, Q. et al. Intravital imaging of mouse embryos. Science (New York, N.Y.) 368, 181-186, doi:10.1126/science.aba0210 (2020).
4. Nagamatsu, G., Shimamoto, S., Hamazaki, N., Nishimura, Y. & Hayashi, K. Mechanical stress accompanied with nuclear rotation is involved in the dormant state of mouse oocytes. Science advances 5, eaav9960, doi:10.1126/sciadv.aav9960 (2019).
5. Ueda, Y. et al. Intrauterine Pressures Adjusted by Reichert's Membrane Are Crucial for Early Mouse Morphogenesis. Cell reports 31, 107637, doi:10.1016/j.celrep.2020.107637 (2020).
6. van Maele-Fabry, G., Delhaise, F. & Picard, J. J. Evolution of the developmental scores of sixteen morphological features in mouse embryos displaying 0 to 30 somites. The International journal of developmental biology 36, 161-167 (1992).
转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




