「 本文共:15条资讯,阅读时长约:3分钟 」




1.礼来偏头痛新药在华报产。礼来开发的Galcanezumab注射液的上市申请获CDE受理,推测适应症为预防性治疗成人发作性偏头痛。Galcanezumab(Emgality)是一款CGRP单抗,已获FDA批准上市,用于预防性治疗偏头痛,以及用于治疗成人阵发性丛集性头痛。今年4月,诺华的CGRP单抗Erenumab注射液也在中国申报上市,用于预防成人偏头痛。
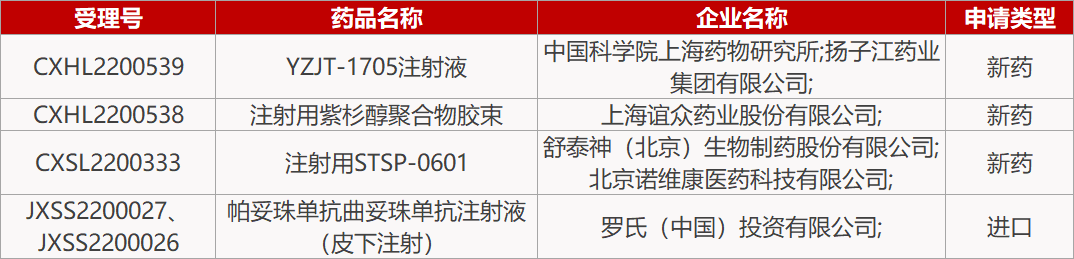
2.罗氏皮下注射抗体复方在华报产。罗氏开发的帕妥珠单抗曲妥珠单抗注射液(皮下注射)的新药上市申请获CDE受理。这是一款包含帕妥珠单抗、曲妥珠单抗与透明质酸酶的皮下注射固定剂量组合(商品名为Phesgo),已在美国、欧盟等国家和地区获批,用于治疗早期和转移性HER2阳性乳腺癌患者。与标准静脉给药的数小时相比,Phesgo可在5~8分钟内将帕妥珠单抗和曲妥珠单抗以更快的方式完成给药,大幅缩短给药时间。
3.阿斯利康高钾血症新药启动儿科III期临床。阿斯利康环硅酸锆钠在国内登记启动一项III期临床(登记号:CTR20221841),评估用于治疗<18岁儿童高钾血症的疗效、安全性和耐受性。目标入组人数为170人,其中国内30人。主要研究者由首都医科大学附属北京儿童医院医学博士王辉担任。环硅酸锆钠是我国第二批临床急需境外新药,已于2020年1月获批上市,用于治疗成人高钾血症。
4.吉利德TIGIT抗体在华获批临床。上海百利佳生申报的1类生物制品domvanalimab注射液获国家药监局临床试验默示许可,拟联合PD-L1抑制剂durvalumab用于治疗肿瘤表达PD-L1且同步放化疗后疾病未进展的不可切除性局部晚期非小细胞肺癌(NSCLC)患者。domvanalimab(AB154)是吉利德科学从Arcus Biosciences公司引进的一款TIGIT靶向单抗,它能够在纳摩尔水平阻断TIGIT活性,从而阻断免疫抑制并且提高免疫活性。该新药全球范围内处于Ⅲ期临床开发阶段。
5.康哲药业购进眼科VEGF/ANG2双抗。康哲药业旗下康哲眼科与友芝友生物制药订立资产转让协议,获得友芝友生物开发的玻璃体腔内注射用靶向VEGF和ANG2的四价双特异性抗体在全球范围的开发、注册、生产及商业化权利,以及产品的所有知识产权。该双抗采用独特的纳米抗体设计,同时通过两种不同的通路有效抑制新生血管异常生长,拟用于治疗眼底新生血管疾病。目前该产品处于临床前阶段。


1.TSLP靶向哮喘新药获CHMP推荐批准。欧盟人用药品委员会(CHMP)推荐批准阿斯利康与安进联合开发的TSLP单抗Tezspire(tezepelumab)上市,用于治疗严重哮喘。在关键Ⅲ期临床NAVIGATOR中,与安慰剂相比,tezepelumab维持治疗使患者每年哮喘急性加重率(AAER)降低56%(p<0.001)。去年12月,Tezspire已获FDA批准上市,是首款治疗严重哮喘没有表型或生物标志物限制的生物制剂。
2.礼来双靶点降糖药减重Ⅲ期成果见刊NEJM。礼来GIP/GLP-1双重激动剂糖尿病治疗药物tirzepatide在《新英格兰医学杂志》上发表Ⅲ期临床SURMOUNT-1积极结果。在未被诊断为糖尿病的肥胖(BMI≥30或BMI≥27并具有高血压、血脂异常等与体重相关的风险因素)患者中,作为低热量饮食的辅助手段,每周注射一次tirzepatide(5mg、10mg和15mg),患者第72周较基线体重平均减少16%(16.1kg)、21.4%(22.2kg)和22.5%(23.6kg),安慰剂组减少了2.4%(2.4kg);血糖恢复正常的患者达到95.3%(vs61.9%);两组至少一种不良反应事件发生率相当。
3.杨森EGFR/c-Met双抗肺癌临床积极。杨森EGFR/MET双抗Rybrevant(amivantamab)联合第三代EGFR酪氨酸激酶抑制剂lazertinib以及含铂化疗,治疗携带EGFR突变的复发/难治性非小细胞癌(NSCLC)的Ⅰb/Ⅱ期临床结果积极。中位随访为7.1个月时,这一组合方案在经治患者中达到50%的总缓解率(ORR)。此外Rybrevant/lazertinib组合在初治患者中表现出100%的ORR。详细结果将于科学会议上公布。
4.渐冻症反义寡核苷酸疗法获FDA优先审评。FDA受理渤健与Ionis公司开发的反义寡核苷酸疗法tofersen新药申请,用于治疗肌萎缩侧索硬化(ALS,渐冻症)。FDA同时授予其优先审评资格,PDUFA日期为明年1月25日。在Ⅲ期临床VALOR中,该试验未达到主要终点;但在12个月的整合性数据显示,提早使用tofersen可帮助持续减少神经微丝(ALS生物标志)量,且减缓许多疗效终点的下降。
5.Nectin-4 ADC晚期尿路上皮癌临床积极。安斯泰来与Seagen公司开发的Nectin-4-ADC药物Padcev(enfortumab vedotin-ejfv)联合PD-1单抗Keytruda(pembrolizumab)一线治疗不可切除局部晚期或转移性尿路上皮癌(la/mUC)的Ib/II期EV-103研究最新结果积极。队列K结果显示,与Padcev单药相比,联合治疗组BICR评估的ORR为64.5%(95%CI:52.7-75.1),达到主要终点;但BICR评估的DOR没有达到终点。该队列与剂量递增队列和扩展队列的疗效与安全性结果基本一致。
6.强生2022年H1业绩公布。7月19日,强生发布2022Q2财报,上半年总收入474.46亿美元,同比增长4.0%,其中Q2实现收入240.20亿美元,同比增长3.0%。制药业务上半年收入261.86亿美元(+6.5%),Q2收入133.17亿美元(+6.7%);医疗器械业务上半年收入138.69亿美元(+2.3%),Q2收入68.98亿美元(-1.1%);消费者保健业务上半年收入73.91亿美元(-1.4%),Q2收入38.05亿美元(-1.3%)。


1.我国成功研制猴痘病毒假病毒标准物质。日前,中国计量科学研究院成功研制出猴痘病毒野生型B6R基因和突变型F3L基因两种假病毒标准物质。中国计量院此次推出的标准物质,通过使用满足计量学特性要求的制备方法、测量方法与计量器具,保证其量值的准确性与溯源性。这两种标准物质可用于猴痘病毒检测试剂盒开发和性能确认、方法验证以及实验室质量控制。目前国内外尚无猴痘病毒假病毒标准物质。
2.美国成全球猴痘病例最多国家。据美国《新闻周刊》网站25日报道,美国疾控中心(CDC)发布的数据显示,全美已报告3846例猴痘确诊病例,成为世界上猴痘病例最多的国家。美国猴痘病例数3天内猛增了33%,并超过西班牙报告的猴痘确诊病例数(3125例)。美国猴痘病例最多的州是纽约州(990例),其次是加利福尼亚州(356例)。
3.2022-2023美国最佳医院排名公布。7月26日,由《美国新闻与世界报道》(U.S. News & World Report) 评选的全美最佳医院最新发布的2022-2023年度美国“最佳医院荣誉榜”放榜。排位TOP10的医院分别为:明尼苏达州罗切斯特市妙佑诊所、洛杉矶西达赛奈医疗中心、纽约大学朗格尼医学中心、克利夫兰诊所、巴尔的摩约翰霍普金斯医院、洛杉矶加州大学洛杉矶分校医学中心、哥伦比亚和康奈尔- 纽约长老会医院、马萨诸塞州总医院、芝加哥西北纪念医院和斯坦福医疗保健-斯坦福医院。




上个交易日 A 股医药板块 -0.51%
涨幅前三 跌幅前三
睿昂基因+13.44% 奥翔药业-10.00%
之江生物+10.21% 新华制药 -6.76%
赛隆药业+10.01% 华润双鹤 -6.66%
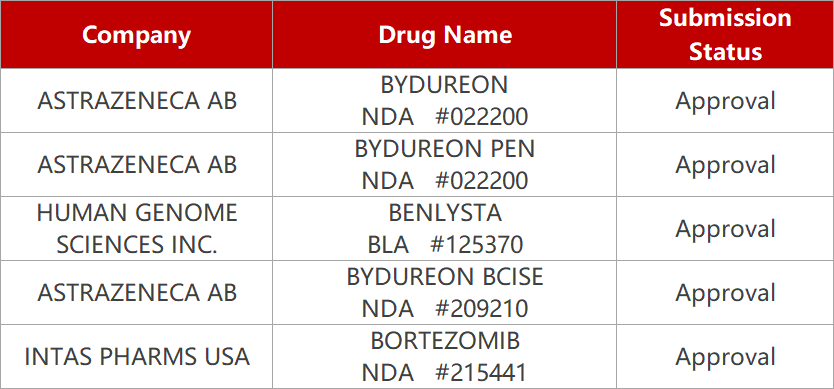
【健友股份】子公司产品注射用硼替佐米'获得美国FDA批准。
【普利制药】环磷酰胺原料药收到FDA接收通知函。
【舒泰神】全资子公司StaidsonBiopharma Inc.产品“STSA-1002注射液和STSA-1005注射液“联用的临床试验申请获得受理。
- The End -





 个人中心
个人中心
 我是园区
我是园区




