
当下,抗肿瘤药物的研发如火如荼,但是总体的研发成功率较低。数据显示[1],2011年至2020年,所有新药从I期临床研究至获批上市的总体成功率为7.9%,而肿瘤药物转化成功率仅为5.3%。在抗肿瘤药物的早期临床研究阶段做合理的规划,有助于下一步临床研究策略的制定,提高抗肿瘤药物的研发成功率。因此,早期临床研究方案的各个设计要点必须反复推敲,正可谓欲事之无繁,则必劳于始而逸于终。
泰格医药科学事务副总裁时岚博士带领的科学事务部团队,十余年来专注于I-IV期临床试验方案、临床试验总结报告、新药临床研究申请(Investigational New Drug,IND)和新药申请(New Drug Application,NDA)申报材料、风险控制计划、临床开发计划等医学材料的撰写,在抗肿瘤药物临床试验方案设计方面积累了丰富的项目经验。近期,时岚博士在由泰格医药主办的早期临床研究策略研讨会上作题为《抗肿瘤药物早期临床研究设计》的分享,我们将分上篇——抗肿瘤药物早期临床研究的设计和下篇——抗肿瘤药物早期研发新方法,来介绍时岚博士对抗肿瘤药物早期研发的洞见。

创新药的研发的7个“Right”
抗肿瘤创新药的成功研发离不开7个right——Right Pathway(信号通路)、Right Target(靶点)、Right Molecular(分子结构)、Right Formulation(剂型)、Right Indication(适应症)、Right Patients(患者)、Right Dosage(剂量)。早期探索性临床研究则需要回答Formulation、Indication、Patients、Dosage四个“R”。
早期临床研究评价考量主要围绕研发立题合理性(科学基础)和方案设计科学性展开。研发立题合理性包括:1)非临床机制研究是否支持,毒理研究是否充分;2)同靶点药物的研发进展;3)临床需求。方案设计科学性须考虑的方面有:1)起始剂量设计是否合理,爬坡设计是否恰当;2)研究人群是否符合当下的临床实践并排除了高危风险患者;3)剂量限制性毒性(Dose Limited Toxicity,DLT)定义是否合理,有无明确的爬坡停止标准;4)安全监控是否充分,有无完备的风险控制计划;5)剂量探索是否充分;6)是否找到合适的敏感瘤种。
I期临床试验设计要点
试验目的
I期临床试验主要探究药物的不良反应以及药物的吸收和代谢,因此I期临床试验研究的主要类型是人体耐受性试验和人体药代动力学试验。

表 1 I期临床试验概况
舒尼替尼(Sunitinib、SU011248、Sutent)是一种多靶点的生物靶向抗肿瘤药物,能同时抑制多条信号传导通路,具有抗肿瘤和抗血管生成的作用。以舒尼替尼的I期研究为例,其I期研究的主要目的是探索最大耐受剂量(Maximum Tolerance dose,MTD)、确定Ⅱ期临床研究推荐剂量(Recommended Phase II Dose,RP2D)。次要目的是探索舒尼替尼的药代动力学(Pharmacokinetic,PK)/药效学(Pharmacodynamics,PD)特征,探索药物的初步疗效。
对于小分子靶向药物I期研究中单次给药剂量递增(Single Ascending Dose,SAD)和多次给药剂量递增(Multiple Ascending Dose,MAD)合并的设计,应该在单次给药后多久开始多次给药?时岚博士回答:第一天单次给药,收集耐受性和PK信息,间隔一周后,开始连续给药,28天为一个疗程,在第28天收集多次给药的信息。
受试人群
抗肿瘤药物原则上在肿瘤患者中进行,且至少满足以下条件:1)组织病理学/细胞学确诊的肿瘤患者;2)常规治疗无效或缺乏有效治疗手段;3)无主要器官功能异常;4)体力状况较好(评分);5)预期生存期≥3个月。非细胞毒类药物如靶向药物可考虑在健康志愿者中进行I期试验。舒尼替尼在支持其NDA申请的10项 I 期临床试验中,有4项在健康志愿者中进行,包括单剂量的药代学研究、食物对生物利用度的影响研究、药物相互作用研究等。
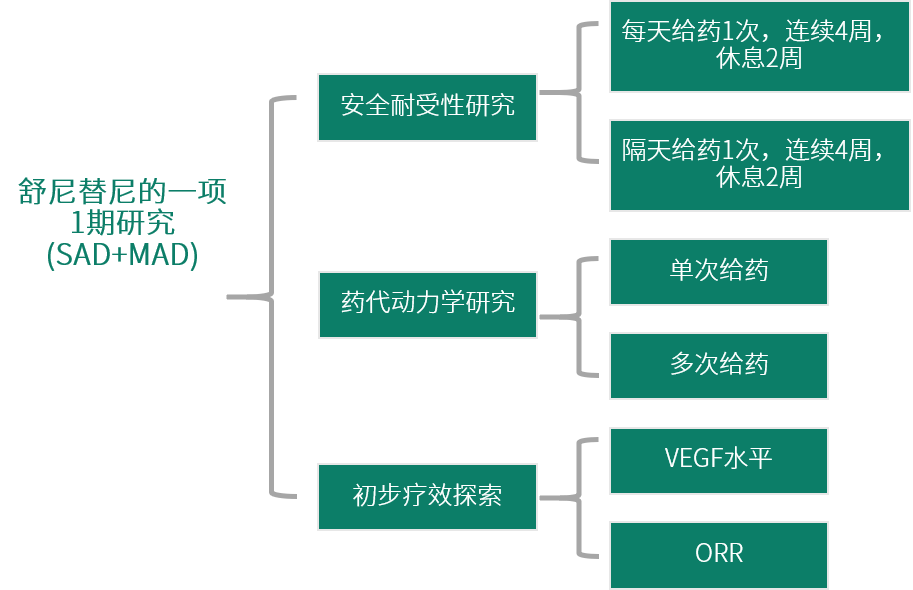
图 1 舒尼替尼的I期研究
此外,若同类药物已有明确预测性的生物标志物时,在剂量扩展试验中可运用该生物标志物检测筛选受试者。在选择剂量扩展阶段纳入的瘤种时,建议结合临床研发策略、临床开发计划、目标上市适应症的市场情况、药政监管当局的政策来综合考虑。
试验设计
药毒同源,所有药物都有毒性,没有药物是完全无毒的。药物和毒药之间的差别在于——剂量。在I期临床试验中,我们关心的是:1)哪个剂量可以作为人类服用的第一个安全剂量;2)哪个剂量可以产生药效(起效剂量);3)哪个剂量可以产生预期最佳药效;4)哪个剂量可能带来毒性反应;5)哪个剂量是人体最大耐受剂量。因此,起始剂量和爬坡方案是I期临床研究方案设计的两个关键点。
理想的首次人体起始剂量应该:1)剂量较低;2)没有明显的毒性风险;3)避免过度的无效剂量递增,以便快速获得II期推荐剂量。以下情况下则应该考虑降低起始剂量:1)剂量反应陡峭,安全窗窄;2)存在严重不可逆的毒性;3)无先兆毒性,出现不明原因的动物死亡;4)全新靶点,机制尚不明确;5)无理想的动物模型以及毒理试验不充分;6)试验药物为特异性激动剂。以下情况下则应该考虑提高药物的起始剂量:1)充分的毒理学实验数据;2)充分的同靶点药物经验;3)排除所有可能降低起始剂量的情况。
起始剂量常用估算方法有最大推荐起始剂量(Maximum Recommended Starting Dose,MRSD)、最大无毒性反应剂量(No Observed Adverse Effect Level,NOAEL)、最小生物效应水平(Minimal Anticipated Biological Effect Level,MABEL)、类似药法(相似作用机制MOA)、PK模型、PKPD模型等,几种方法各有利弊。
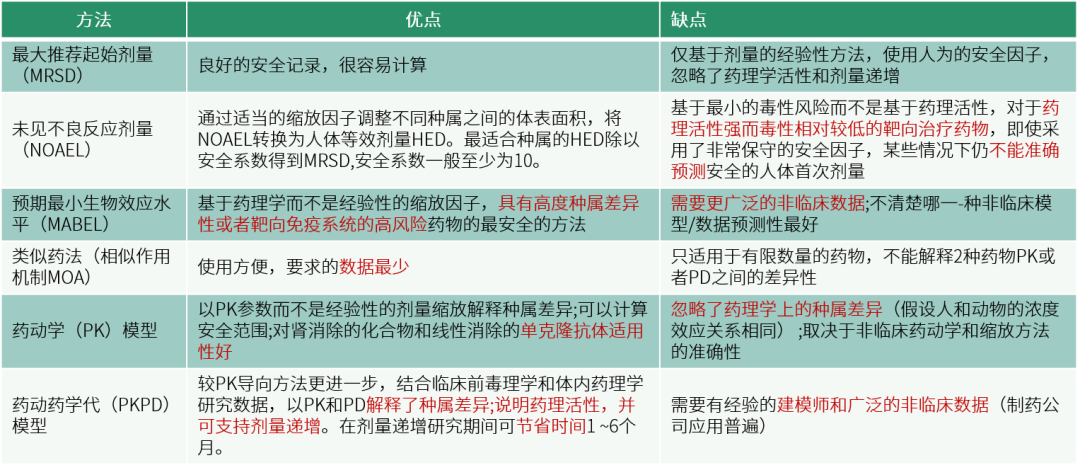
表 2 起始剂量常用估算方法
健康受试者中首次临床试验起始剂量的推算主要依据非临床安全性数据,通常以NOAEL进行推算。小分子药物以啮齿类动物10%动物严重毒性剂量(Dose Severely Toxic to 10% of Animals,STD10)作为起始剂量,如果非啮齿类动物是最合适种属,则认为最高非严重毒性剂量(Highest Non-severely Toxic Dose,HNSTD)的1/6是合适的起始剂量(根据ICH,S9)。对于风险较大的药物(免疫激动剂)或者动物中缺乏相关靶点表达的药物,建议从MABEL的角度考虑起始剂量。抗肿瘤生物技术药物首次临床起始剂量应从靶点相关作用和脱靶作用两个方面来考虑安全性风险。不同生物药物之间的生物作用方式及毒性特点均有较大差异,首次临床起始剂量需具体情况具体分析。
剂量爬坡方案包括基于规则的方法(Rule-based Designs)和基于模型的设计方法(Model-based designs)。基于规则的方法包括:1)传统的“3+3”方法;2)加速滴定设计;3)药理学指导下的剂量爬坡。基于模型设计的方法包括:1)连续重新评估方法(Modified Continual Reassessment Method,CRM);2)过高剂量控制的剂量爬坡方法 (Escalation With Overdose Control,EWOC)。剂量递增的原则应遵循:初期幅度可较大,后期应较小;安全性大活毒性小的药物幅度可大,有的可成倍递增;安全性小或毒性较大的药物递增幅度应小。
给药间隔的设计应考虑抗肿瘤药物的类型,细胞毒类药物给药间隔取决于毒性恢复时间,一般包括单剂量、每日一次、每周一次等给药方法,通过观察单次给药的毒性恢复时间来确定重复给药的间隔时间。靶向药物的给药间隔则取决于达靶点持续抑制稳态浓度,多采用连续给药的方式。此外,还应考虑临床给药的便利性。
I期临床试验设计总结
I期临床试验由于样本量小,无法全面证实药物的安全性及疗效。I期临床研究中,需要避免无效剂量的递增。起始剂量过低或递增太慢以至于无法获得有效信息,如果临床前数据呈现窄治疗窗、动物模型显示有一定的安全性问题、或药物具有一定毒性,则需要对剂量递增速度作谨慎的决策。在爬坡过程中及时根据PK、PD结果调整给药频率,帮助尽快探索到MTD或RP2D。传统“3+3”剂量爬坡方案,研究过程清晰明了,简单易行,对后续剂量和给药方案的设定具有重要参考价值。
抗肿瘤的靶向药物不同于细胞毒性药物,传统的开发模式对于靶向药物并不适用。在靶向药物的剂量探索研究中,毒性可能不是合适的终点。在多数情况下,这类化合物暴露(给药)时间需要延长,才能达到对靶点的持续抑制。
II期临床试验设计要点
抗肿瘤药物的II期临床试验开始前,申办者可能已经收集了以下信息:1)小样本人群的安全性数据,且认为安全性可以接受;2)安全剂量范围,起始剂量-MTD;3)在小样本人群中获得了PK数据,大体可以确定给药频率;4)初步的疗效数据,如客观缓解率(Objective Response Rate,ORR)。
II期临床研究的开展是为了确认下述问题:1)基于累积的疗效和安全性,是否可以进一步开展III期研究;2)用哪个/些给药剂量和方案开展III期;3)哪些是敏感瘤种。
II期临床试验设计
II期临床试验中,试验的主要目的是考察试验药物是否具有抗肿瘤的作用,次要目的是考察药物的安全性,进一步优化给药剂量和方案。受试人群的选择要注意:1)与I期基本相同,或根据Ⅰ期研究结果进行适当调整;2)一般尽可能多选择瘤种分别进行考察,另外需要结合市场情况、临床前数据、I期结果以及同类产品等情况综合考量受试人群的选择;3)按照预先制定好的计划入组患者,用尽可能少的受试者达到研究目的。给药方案应注意:1)一般采用两个或多个剂量组,探索出最佳剂量;2)给药间隔、速度、疗程、剂量调整、联合放化疗方案等都需要探索;3)避免给予影响药物疗效的其他治疗以及可能与试验药存在相互作用的其他药物。
II期临床试验的典型设计为两/多组平行设计和单臂设计,设计方法较为灵活。在有常规标准有效治疗方法时,应尽量采用随机对照设计,并尽可能采用单药治疗。随机对照临床试验设计可应用于评价多种剂量、多种给药方案、试验治疗和标准治疗对比的研究。
II临床试验常用的设计为:一个安慰剂组+数个研究药物的不同剂量组+阳性对照组(也可以没有。若有,可为III期研究做准备)。时岚博士认为,剂量的选择是II期临床研究设计的一个难点。选择多少个剂量组需要慎重考虑,剂量组多,则样本量大,花费的成本较高、时间较长。如果降低每个剂量组样本量,则会导致把握度低,II类错误风险增大。如果选择的剂量组数太少,则估计的最低有效剂量可能大幅偏离真实的最低有效剂量。
Simon’s两阶段设计常用于抗肿瘤药物Ⅱ期临床试验中。通过确定早期终止指标,当试验组疗效未达到预期效果时,可以尽早终止试验,从而避免更多的受试者接受无效治疗,符合伦理学要求,并节约时间和成本。采用Simon’s两阶段设计应注意:1)单臂研究常用于对A适应症的疗效/安全性已经得到确证或基本明确,对有类似/相同发病机制和病理生理的B适应症的II期探索;2)应用于首个适应症时,需慎重考虑。
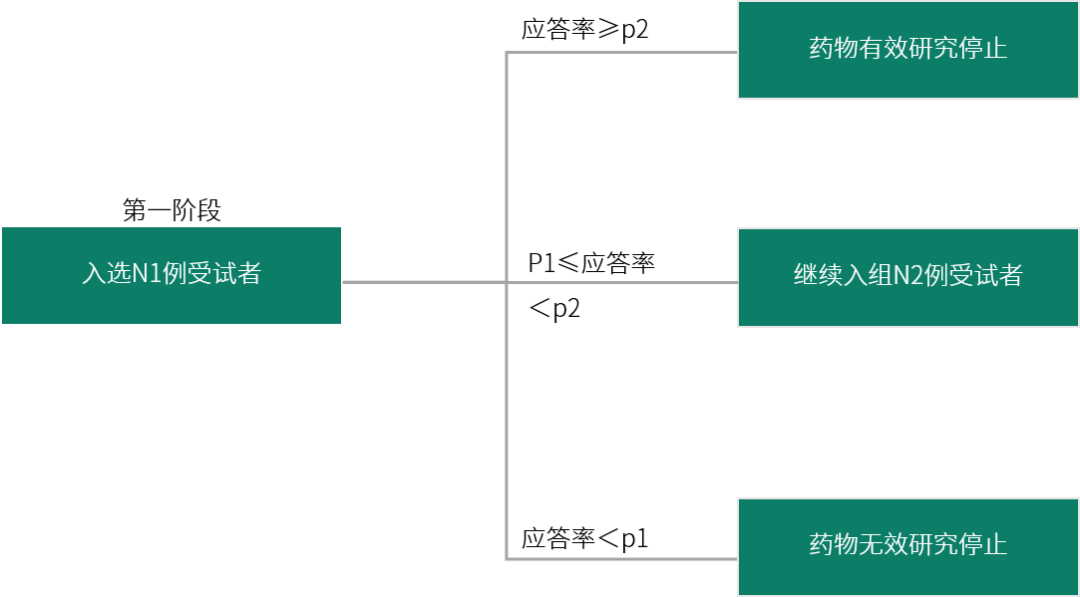
图 2 Simon’s 两阶段设计
抗肿瘤药物II临床试验常用ORR、无进展生存期(Progression Free Survival,PFS)作为主要疗效终点,同时观察其他能反映受试者临床获益的指标(见表 3)。

表 3 II临床试验终点设计
II期临床试验设计总结
时岚博士总结II期临床试验设计要点:1)II期主要目的是初步考察药物的生物活性,因此并非必须获得生存方面的数据才可进入Ⅲ期临床试验;2)II期研究通常采用随机入组,研究药物分成低、中、高3个剂量组,同时可以设参照组,可以是阳性药物或/和安慰剂平行对照,取决于适应症和伦理考虑;3)II期研究主要进行剂量探索和选择,确定剂量-效应关系的存在,并确定合适的剂量;4)II期本质上是个探索和估计的过程,很少做统计学假设检验;5)孤儿药或有重大突破性疗法新药在完成II期临床试验后,申办者可向中国国家药品监督管理局(National Medical Products Administration,NMPA)和美国食品药品监督管理局(Food and Drug Administration,FDA)申请上市,监管机构在评估患者利益/风险比后,可“有条件批准”该类新药基于临床II期数据提前上市销售。
参考文献
[1]Clinical Development Success Rates and Contributing Factors 2011–2020.
https://www.bio.org/clinical-development-success-rates-and-contributing-factors-2011-2020[DB/OL]
关于泰格医药科学事务部
科学事务部团队专注于I-IV期药物和医疗器械临床试验方案、BE试验方案、临床研究总结报告、新药IND和NDA申报资料、临床开发计划、临床研究综述、研究者手册、药物临床试验风险控制计划和患者知情同意书等医学相关资料的撰写。成立十余年来,为国内外知名制药企业、创新药研发公司提供优质、高效、合规的医学撰写服务,已经累积了数百个临床项目的撰写经验。项目经验涉及各个疾病领域,尤其擅长肿瘤、呼吸、免疫、神经、血液、消化、骨伤等;涵盖的产品以创新药为主,也有仿制药和医疗器械,更有当下肿瘤药物研究领域的热点研究药物。目前,科学事务部团队由近30位具备医药背景的高学历人才组成,核心成员具备丰富的医学资料的撰写和翻译经验,可与其他职能部门密切合作,共同保障临床试验和质量和进度。
文 | 任倩倩
Tigermed
泰格医药
泰格医药(股票代码:300347.SZ/3347.HK)是行业领先的一体化生物医药研发服务平台,为全球制药和医疗器械行业提供跨越全周期的临床研究创新解决方案。通过全面的服务体系和顶尖的质量标准,我们助力生物医药产业提升研发效率、降低研发风险,确保研究项目高质量交付,加速医药产品市场化进程,履行对行业和患者的承诺。同时,我们也通过覆盖各领域的60多家子公司,打造赋能全产业链的创新生态,推动医疗产业创新和发展。作为全球化的研发平台,泰格医药在全球布局150多个办事处和研发基地,拥有超过6400人的专业团队,覆盖5大洲的39个国家,致力于解决最具挑战的全球健康问题,满足患者的未尽医疗需求,创造社会价值,造福人类健康。
网址: www.tigermedgrp.com
邮箱: marketing@tigermedgrp.com
注:本公众号发布内容仅供一般参考之用,不可视为详尽说明,亦不构成信息披露和投资建议,投资者不应以该等内容取代其独立判断或仅根据该等内容做出决策。





 个人中心
个人中心
 我是园区
我是园区




