2022年12月8日,赛生药业发布公告,宣布达佑泽®(那西妥单抗注射液)获得国家药品监督管理局(NMPA)批准,与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合给药,用于治疗复发性或难治性高危神经母细胞瘤的儿童(1岁及以上)或成人患者。这是继达妥昔单抗β之后,在我国获批的第二款GD2单抗,为神经母细胞瘤的患者带来了更多治疗选择。

图1:赛生药业宣布那西妥单抗获批的公告截图
神经母细胞瘤起源于交感神经系统,是婴幼儿最常见的颅外实体肿瘤,在中国约占儿童恶性肿瘤的8%~10%。临床表现为肿瘤压迫,肿瘤浸润、转移瘤,以及儿茶酚胺代谢率增高等。美国国家癌症研究所的儿童肿瘤研究组(COG)根据发病年龄、肿瘤特征和肿瘤是否扩散将患者风险等级分为低危、中危和高危组三级。半数以上患者确诊时已经是高危,高危组的5年无病生存率仅为40%。因为恶性程度高、治疗难度大,神经母细胞瘤被称为“儿童肿瘤之王”。
在GD2单抗免疫疗法之前,神经母细胞瘤的治疗手段主要集中在手术、化疗、放疗以及干细胞移植等。在成人实体瘤取得突破性疗效的PD-1/PD-L1免疫检查点抑制剂在神经母细胞瘤响应率却很低,这是因为神经母细胞瘤具有多种免疫逃逸机制,是免疫“冷”肿瘤,导致激发内源性的免疫识别效果不佳。
随着对神经母细胞瘤的深入研究,研究者发现神经母细胞瘤细胞的表面稳定高表达一种含有唾液酸的糖鞘脂GD2,而GD2在正常组织细胞表达有限,是治疗神经母细胞瘤的完美靶点。GD2单抗主要通过抗体依赖的细胞毒性作用(ADCC)来进行肿瘤细胞的杀伤,GD2单抗的Fab段结合肿瘤细胞的GD2,Fc段与杀伤细胞(NK细胞、巨噬细胞等)表面的FcR结合,介导杀伤细胞直接杀伤肿瘤细胞。
目前已获批治疗神经母细胞瘤的GD2单抗主要源于两种抗体:Ch14.18(以及更早的鼠源版本14G2a)和3F8。其中Ch14.18衍生出两种单抗药物:达妥昔单抗和达妥昔单抗β,于2015年和2017年分别在美国和欧盟被批准上市。由3F8衍生的那西妥单抗2020年被FDA加速批准上市。达妥昔单抗类属于人-鼠嵌合抗体(“ch”代表“嵌合”,Ch14.18的抗体可变区来自鼠源的IgG3抗体,恒定区来自于人源的IgG1抗体),而那西妥单抗则是由移植技术改造的人源抗体,大幅降低异源免疫应答产生的风险(见图2)。
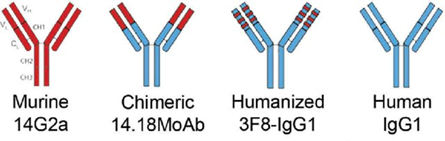
图2:GD2单抗的结构示意图。
红色代表鼠源,蓝色代表人源
来源:Jaume Mora (2016). DOI: 10.1586/17512433.2016.1160775
就关键临床的疗效来看,达妥昔单抗β和那西妥单抗数据相近:达妥昔单抗β在APN311-202研究和APN311-303研究分别达到了42%(n=33)和28%(n=36)的ORR;而那西妥单抗在201研究和12-230研究分别达到45%(n=22)和34%(n=47)的ORR。那西妥单抗相比于达妥昔单抗有输液时间短的优势,仅需30-60分钟,这意味着门诊用药的可行性,而达妥昔单抗类则需要10到20小时的输液时间。
智能药物大数据分析平台Pharma ONE监测到目前有6款阶段在临床II期及以上的靶向GD2的药物(表1)。除了已获批的3款药物以外,另有3种药物同样来源于ch14.18或3F8。hu14.18K322A如其名称所示,是含有一个单碱基替换(K322A)的人源14.18抗体,这样的改造减少了补体依赖性的裂解。lorukafusp alfa是ch14.18与IL-2的抗体融合蛋白。碘-3F8是由3F8组成的放射免疫偶联物。
表1:临床二期以上靶向GD2的药物进展情况
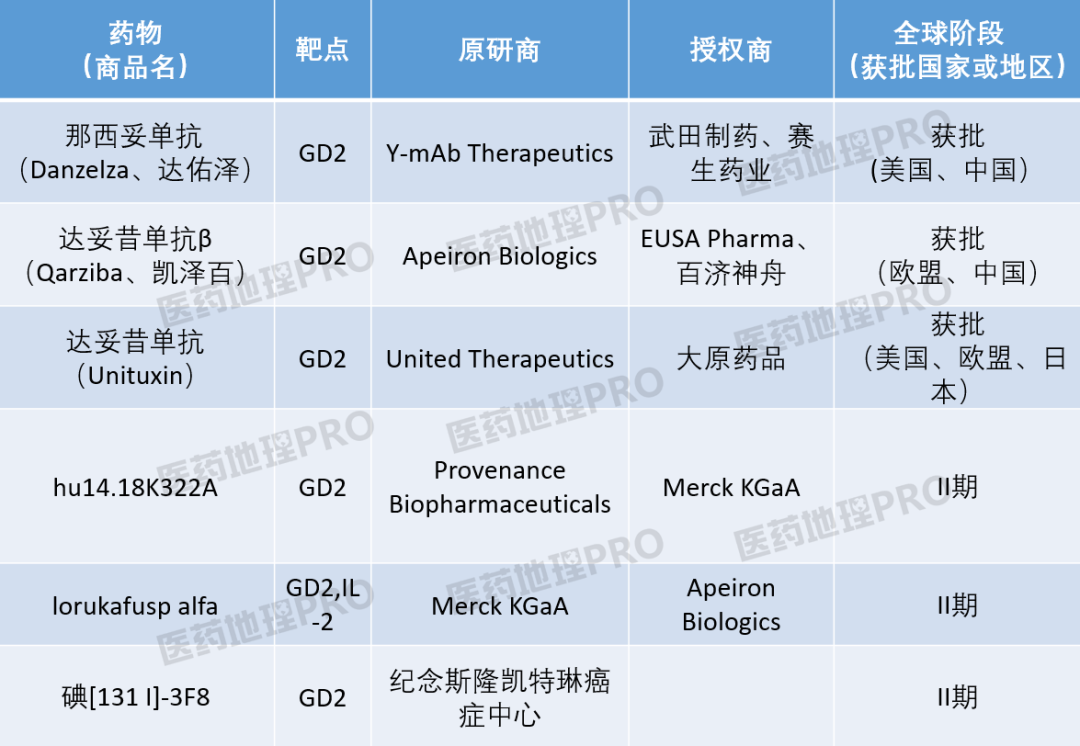
来源:Pharma ONE, 中国医药工业信息中心
那西妥单抗在国内的获批得益于我国鼓励儿童用药等创新药开发的有关政策与规定,NMPA药品审评中心(CDE)同意豁免那西妥单抗在中国的关键性临床研究,并将其上市申请纳入优先审评。而在正式获批之前,由于“先行先试”的有关规定,那西妥单抗于21年6月和12月分别落地海南博鳌乐城国际医疗旅游先行区和天津自由贸易试验区。我们期待着未来有更多的新药获批,惠及我国的神经母细胞瘤患者群体!


如需获取更多数据洞察信息或公众号内容合作,请联系医药地理小助手微信号:pharmadl001




 个人中心
个人中心
 我是园区
我是园区




