您还不是认证园区!
赶快前去认证园区吧!

图一 再鼎医药最近的三项重要合作

近日,再鼎以2500万美元的预付款和最高至3.36亿美元的潜在里程碑付款及特许权使用费从Turning Point Therapeutics引进口服多靶点激酶抑制剂TPX-0022,其全新的大环结构可抑制MET、CSF1R和SRC基因靶点突变。TPX-0022的IND申请已在美国获批,并于2019年下半年启动了针对MET/HGF或CSF1R/SCF1R突变的晚期或转移性实体瘤患者的SHIELD-1一期临床研究。此项引进将进一步加强再鼎在胃癌和肺癌领域的布局。
在此之前,与Cullinan Oncology的合作让再鼎将肺癌领域潜在治疗药物CLN-081收入囊中。CLN-081是一种口服小分子、下一代不可逆的EGFR抑制剂,可以选择性地靶向作用于表达EGFR突变型的细胞,目前正在进行的一项1/2a期剂量递增和扩展研究。根据协议,Cullinan Oncology将获得2000万美元的预付款和最高2.11亿美元的潜在里程碑付款及特许权使用费。
据介绍,以上三项资产均针对中国乃至全球目前尚未满足临床需求,且可能成为潜在的“best-in-class”或“first-in-class”品种。
通过授权引进和自主研发,再鼎目前的在研管线共包含21项资产,覆盖多个疾病领域。其中处于后期阶段的有10项,拥有全球权利的内部开发资产有7项,已获得FDA批准的有5项。
聚焦国内获批情况,再鼎治疗胶质母细胞瘤的全球首款肿瘤电场治疗产品(爱普盾)和用于卵巢癌的口服PARP抑制剂尼拉帕利(则乐)已获批上市。在则乐通过刚刚结束的医保谈判顺利进入国家医保目录之前,已布局了18项商业健康保险;爱普盾虽未进入国家医保,也通过与多项补充保险计划合作增强了患者可及性。
图二 再鼎医药目前在研管线
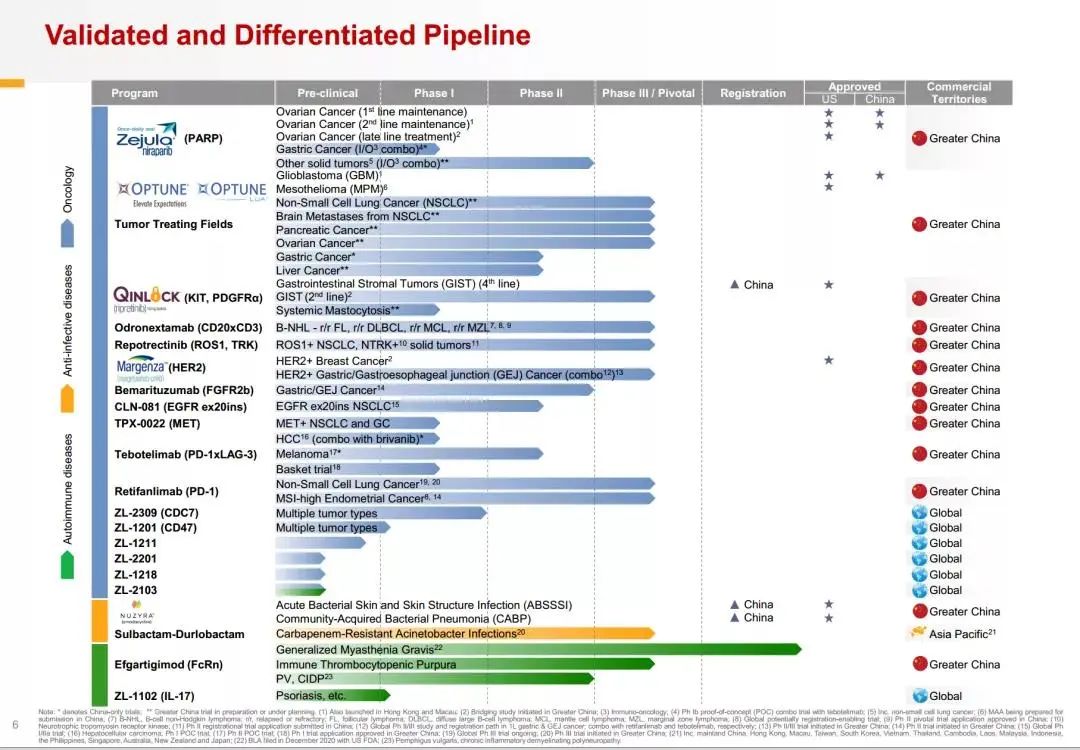
此外,再鼎最近更新的研发管线中首次纳入靶向CDC7的ZL-2309,潜在适应症涉及多个肿瘤类型,现已开展I期临床试验。
在报告的最后,杜莹博士回顾了再鼎自2014年成立以来的多个里程碑,2017年赴纳斯达克上市,2020年于港交所上市。下一个三年,再鼎希望进入一个全新的阶段,成为一家全球领先的生物制药公司,为中国乃至全世界带来更多创新疗法。




 个人中心
个人中心
 我是园区
我是园区




