核酸药是现今药物研发的热点领域之一,在传染性疾病、肿瘤、慢性病等方面不断取得进展。在核酸药物的众多类型中,小核酸药物由于具有靶点丰富、研发周期短、药效持久等特点,临床优势日益凸显。2021年,全球小核酸药物市场规模达到32.5亿美金,过去四年行业复合增长率达到33%,预计2024年将达到86亿美金。小核酸药物开发过程中有三个关键环节,分别是序列设计、合成与修饰以及递送系统,而该市场未来几年主要增长驱动力正是来自于全新递送技术的突破。Biacore作为药物研发中不可或缺的互作技术,已经广泛应用于小分子药物及抗体的研究,对于小核酸药物递送壁垒的突破又能提供哪些助力呢?接下来我们从siRNA药物的靶向递送和PNA的研发当中一起寻找答案吧。
siRNA药物作为小核酸药中最常见的一种,凭借其高效的基因沉默效率、可控的不良反应以及合成方便等优点,成为核酸药物研发的一大热点。但是siRNA的体内递送一直是研发的难点,如何将siRNA高效、安全地递送到靶组织一直是siRNA临床转化面临的挑战。近年来已经出现多种成熟的递送方式,例如脂质纳米颗粒(LNP)递送,乙酰半乳糖胺(GalNAc)递送等等。在此基础之上,核酸药物的研发人员也一直在进行技术创新,尝试新的siRNA递送方式。
2022年日本 Kyowa Kirin公司报道了一种化学修饰的甘露糖配体递送模式(CMM4-siRNA),该模式靶向巨噬细胞(macrophages)和树突状细胞(dendritic cells)上一种内吞性的甘露糖受体CD206,将siRNA药物递送至巨噬细胞/DCs表面,通过CD206介导的内吞作用使siRNA进入细胞,从而沉默靶基因(图1)。
但是,天然甘露糖与CD206的亲和力较弱,因此在研发早期研究人员选用Biacore对化学合成的甘露糖进行了筛选和优化。对于合成的一系列甘露糖单体(4a-4f),基于Biacore设计的竞争抑制实验,评估其结合活性。如图2A所示,实验中将生物素化的天然甘露糖固定到SA芯片上,在固定浓度的CD206中预混不同浓度的待测样品(4a-4f),得到图2B的竞争抑制曲线。从图2C的表格中可以看出,4a和4f的竞争抑制能力最强,IC50分别达到<0.160μmol/L和0.735μmol/L,抑制活性比α-甲基-甘露糖高出至少1000倍。
图2,Biacore竞争抑制实验筛选高结合活性的甘露糖单体
在Biacore实验结论的基础上,研究人员最终选择结合活性最强的4a经过进一步修饰得到了与siRNA的四价甘露糖偶联物CMM4-siRNA。用Biacore对CMM4-siRNA与CD206的亲和力进行了精确表征,将CD206通过anti-his抗体捕获到芯片表面(图3A),CMM4-siRNA作为分析物检测,结果表明两者的亲和力达到了2.9nM(图3B)。为了进一步确认CMM4-siRNA结合的特异性,研究人员评估了CMM4-siRNA与一系列糖结合受体的结合活性。结果表明不管是其他的甘露糖识别受体CD209,还是非甘露糖结合受体ASGPR,抑或甘露糖结合凝集素CD205,都与CMM4-siRNA没有结合或者具有明显更低的结合活性(图3C)。这一结果确认了CMM4-siRNA偶联物的结合特异性和强结合能力。
图3,Biacore检测CMM4-siRNA与CD206的亲和力及其他糖结合受体的结合特异性
在后续的细胞及动物实验中,CMM4-siRNA在表达CD206的细胞中也表现出了强大且持续的基因沉默能力,有效下调目标蛋白的表达量。这种化学合成修饰的甘露糖偶联的siRNA药物极大地拓展了siRNA的应用领域,也为今后siRNA药物的靶向递送提供了创新的理论基础。
说到靶向递送,以抗体偶联修饰siRNA(antibody-siRNA conjugates, ARC)的递送方法也是特异性递送的热点领域。2020年小核酸药物领域三巨头之一的Alnylam公司与美国Scripps研究所发表文章,介绍了一种基于双可变区(dual variable domain,DVD)抗体的ARC平台,能够高效地得到ARC偶联物,并且不会影响抗体与靶点的亲和力。
文章中采用Biacore评估偶联是否会影响抗体与靶点的亲和力,从图4的定量数据中可以清晰地看到,不管是siRNA4还是siRNA5的抗体偶联物,都不会影响与BCMA靶点的结合。
图4,Biacore检测抗体及抗体偶联物与BCMA的结合
肽核酸(PNA, peptide nucleic acid)是一种新型高效的microRNA抑制剂,以多肽骨架取代戊糖磷酸主链的DNA类似物。由于PNA不带负电荷,与核酸结合的稳定性和特异性都大为提高,具有广阔的应用前景。
2022年,科罗拉多大学和Sachi Bioworks公司共同发表的一篇文章中,报道了一种靶向新冠miRNA的PNA抑制剂SBCoV207,能够特异性结合miR-2392,在动物实验中表现出高度有效性和安全性(图5)。
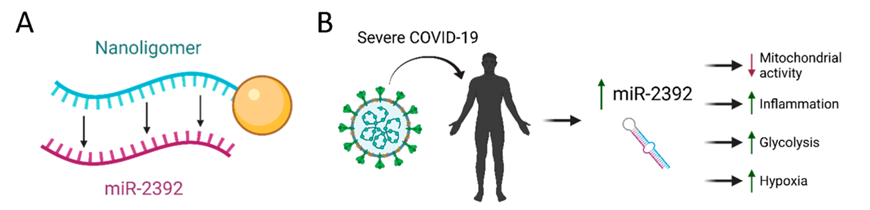 图5,PNA通过靶向结合miR-2392发挥治疗新冠的作用
如何证明SBCoV207能特异性识别miR-2392呢?
研究人员在Biacore上设计了互作实验:
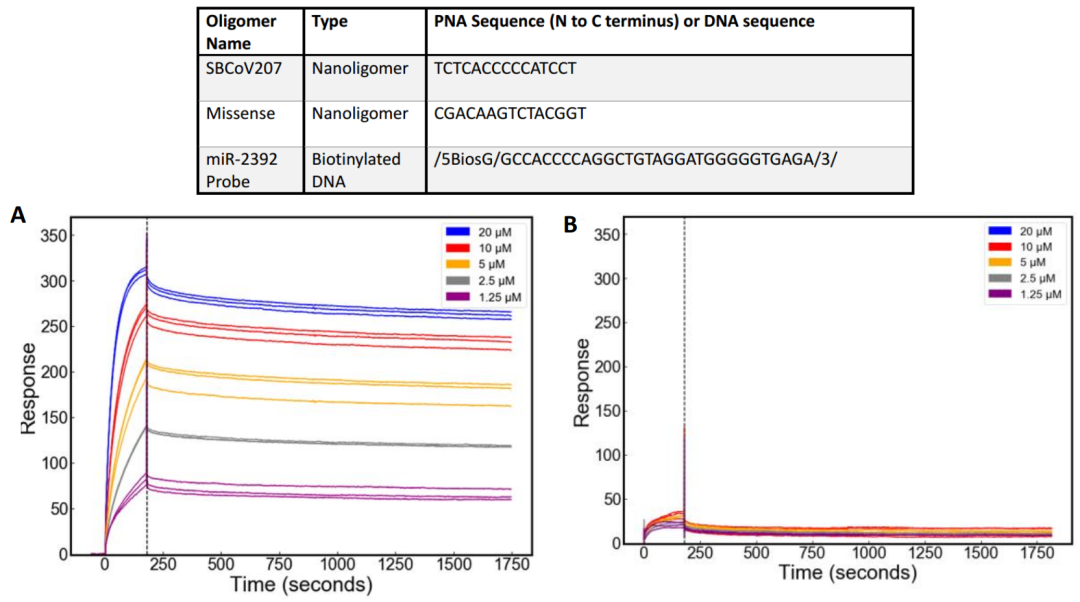
将生物素化的miR-2392固定在SA芯片表面,SBCoV207作为分析物进样(图6A),得到两者之间的亲和力为48.11nM,结合速率ka=1372M
-1
s
-1
,解离速率kd= 6.56 × 10
5
s
-1
,这种慢解离正是PNA与目的核酸结合的特征之一。
从对照实验可以看出(图6B),错义核酸对照(Missense)与miR-2392几乎没有响应信号,可以排除非特异结合对该实验的影响,说明Biacore实验结果的可信度。
Biacore上得到的定量数据在体外证明了SBCoV207与目的核酸片段miR-2392具有高亲和力,特别是具有慢解离的特性,能够和目的核酸互补稳定结合。
图6,Biacore检测SBCoV207/Missense与目的核酸的结合以及使用的核酸序列
Biacore作为唯一收录于中美日三国药典的分子互作金标准,在小核酸药物的研发中同样具有多重应用。除了能够提供精准的定量数据之外,还可以设计抑制实验得到更多的竞争数据,高灵敏度和分辨率能够准确区分不同样品亲和力的差异。对于核酸类的样品,Biacore提供了多种解决方案,除了能够将核酸作为分析物检测之外,SA/NA/CAP芯片可以实现核酸的可逆/不可逆捕获,方便不同研发目的的实验设计。
核酸药物被认为是继小分子药物、抗体之后的现代新药第三次浪潮,虽然在研发过程中还存在着诸多挑战,但是相信在Biacore的助力下,小核酸药物的应用领域和技术领域将不断突破创新,在未来将有更广阔的发展。
1.Uehara K, Harumoto T, Makino A, Koda Y, Iwano J, Suzuki Y, Tanigawa M, Iwai H, Asano K, Kurihara K, Hamaguchi A, Kodaira H, Atsumi T, Yamada Y, Tomizuka K. Targeted delivery to macrophages and dendritic cells by chemically modified mannose ligand-conjugated siRNA. Nucleic Acids Res. 2022 May 20;50(9):4840-4859. doi: 10.1093/nar/gkac308. PMID: 35524566; PMCID: PMC9122583.
2.Nanna AR, Kel'in AV, Theile C, Pierson JM, Voo ZX, Garg A, Nair JK, Maier MA, Fitzgerald K, Rader C. Generation and validation of structurally defined antibody-siRNA conjugates. Nucleic Acids Res. 2020 Jun 4;48(10):5281-5293. doi: 10.1093/nar/gkaa286. PMID: 32347936; PMCID: PMC7261152.
3.McCollum CR, Courtney CM, O'Connor NJ, Aunins TR, Ding Y, Jordan TX, Rogers KL, Brindley S, Brown JM, Nagpal P, Chatterjee A. Nanoligomers Targeting Human miRNA for the Treatment of Severe COVID-19 Are Safe and Nontoxic in Mice. ACS Biomater Sci Eng. 2022 Jul 11;8(7):3087-3106. doi: 10.1021/acsbiomaterials.2c00510. Epub 2022 Jun 21. PMID: 35729709; PMCID: PMC9236218.
4.行业分析数据来源:SWS Research: 小核酸药物行业分析
图5,PNA通过靶向结合miR-2392发挥治疗新冠的作用
如何证明SBCoV207能特异性识别miR-2392呢?
研究人员在Biacore上设计了互作实验:
将生物素化的miR-2392固定在SA芯片表面,SBCoV207作为分析物进样(图6A),得到两者之间的亲和力为48.11nM,结合速率ka=1372M
-1
s
-1
,解离速率kd= 6.56 × 10
5
s
-1
,这种慢解离正是PNA与目的核酸结合的特征之一。
从对照实验可以看出(图6B),错义核酸对照(Missense)与miR-2392几乎没有响应信号,可以排除非特异结合对该实验的影响,说明Biacore实验结果的可信度。
Biacore上得到的定量数据在体外证明了SBCoV207与目的核酸片段miR-2392具有高亲和力,特别是具有慢解离的特性,能够和目的核酸互补稳定结合。
图6,Biacore检测SBCoV207/Missense与目的核酸的结合以及使用的核酸序列
Biacore作为唯一收录于中美日三国药典的分子互作金标准,在小核酸药物的研发中同样具有多重应用。除了能够提供精准的定量数据之外,还可以设计抑制实验得到更多的竞争数据,高灵敏度和分辨率能够准确区分不同样品亲和力的差异。对于核酸类的样品,Biacore提供了多种解决方案,除了能够将核酸作为分析物检测之外,SA/NA/CAP芯片可以实现核酸的可逆/不可逆捕获,方便不同研发目的的实验设计。
核酸药物被认为是继小分子药物、抗体之后的现代新药第三次浪潮,虽然在研发过程中还存在着诸多挑战,但是相信在Biacore的助力下,小核酸药物的应用领域和技术领域将不断突破创新,在未来将有更广阔的发展。
1.Uehara K, Harumoto T, Makino A, Koda Y, Iwano J, Suzuki Y, Tanigawa M, Iwai H, Asano K, Kurihara K, Hamaguchi A, Kodaira H, Atsumi T, Yamada Y, Tomizuka K. Targeted delivery to macrophages and dendritic cells by chemically modified mannose ligand-conjugated siRNA. Nucleic Acids Res. 2022 May 20;50(9):4840-4859. doi: 10.1093/nar/gkac308. PMID: 35524566; PMCID: PMC9122583.
2.Nanna AR, Kel'in AV, Theile C, Pierson JM, Voo ZX, Garg A, Nair JK, Maier MA, Fitzgerald K, Rader C. Generation and validation of structurally defined antibody-siRNA conjugates. Nucleic Acids Res. 2020 Jun 4;48(10):5281-5293. doi: 10.1093/nar/gkaa286. PMID: 32347936; PMCID: PMC7261152.
3.McCollum CR, Courtney CM, O'Connor NJ, Aunins TR, Ding Y, Jordan TX, Rogers KL, Brindley S, Brown JM, Nagpal P, Chatterjee A. Nanoligomers Targeting Human miRNA for the Treatment of Severe COVID-19 Are Safe and Nontoxic in Mice. ACS Biomater Sci Eng. 2022 Jul 11;8(7):3087-3106. doi: 10.1021/acsbiomaterials.2c00510. Epub 2022 Jun 21. PMID: 35729709; PMCID: PMC9236218.
4.行业分析数据来源:SWS Research: 小核酸药物行业分析
识别微信二维码,添加生物制品圈小编,符合条件者即可加入
生物制品微信群!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。

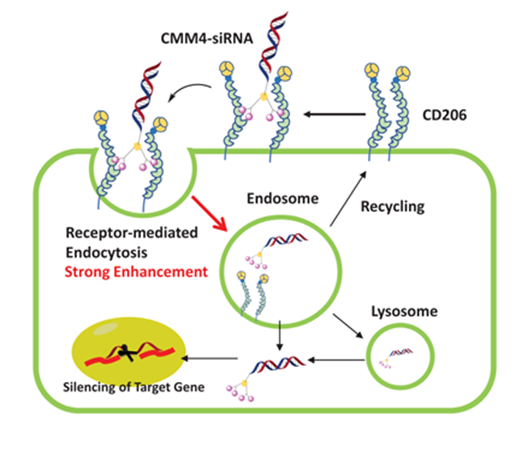
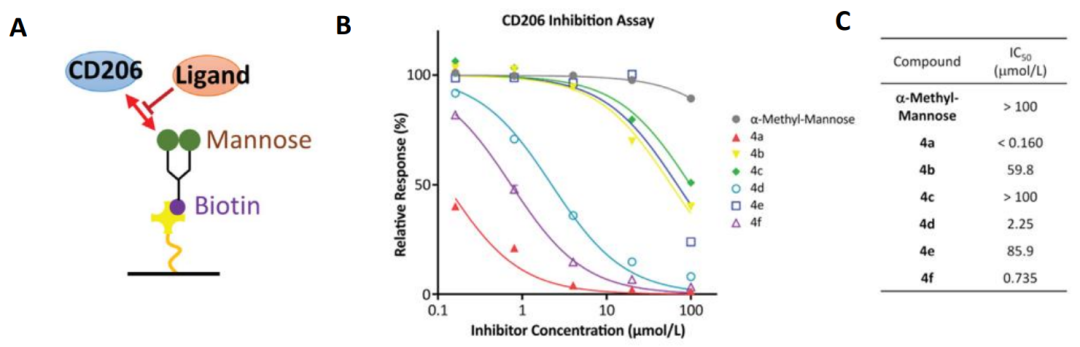
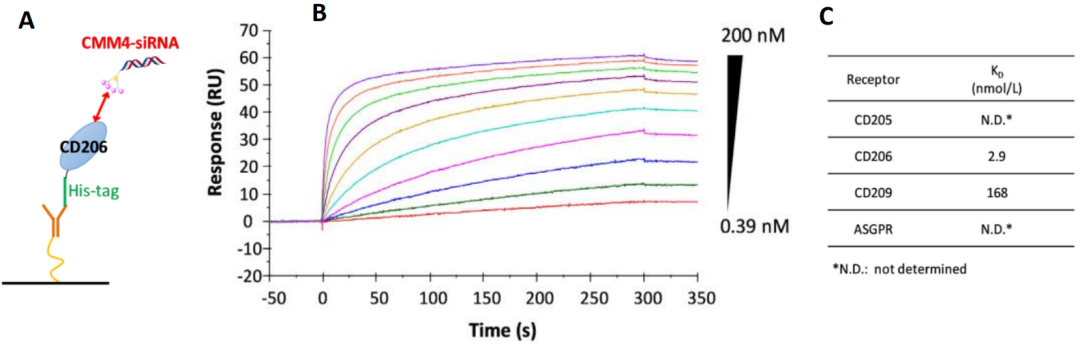
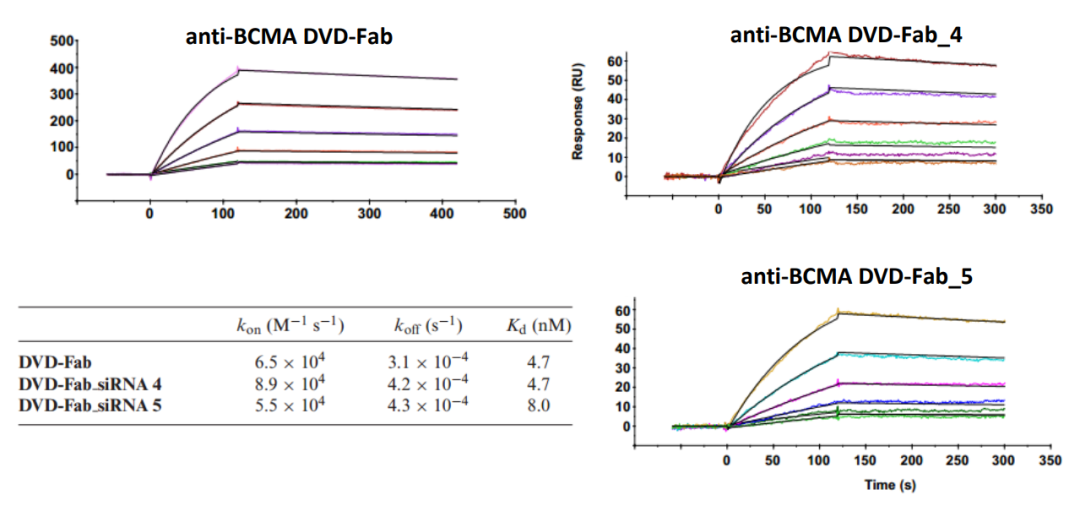
 图5,PNA通过靶向结合miR-2392发挥治疗新冠的作用
图5,PNA通过靶向结合miR-2392发挥治疗新冠的作用







 个人中心
个人中心
 我是园区
我是园区




